歐盟的Basic-UDI是歐盟醫(yī)療器械CE認(rèn)證法規(guī)中的一個概念�����,Basic UDI-DI跟著文件走�����,體現(xiàn)在證書����、符合性聲明和技術(shù)文件中����,實現(xiàn)的是文件對應(yīng)的產(chǎn)品組的識別。Basic UDI-DI的要求已經(jīng)于2021年5月26日開始生效���,廣大制造商需要盡快申請編碼并納入自身的MDR文件體系���。
一、Basic-UDI的組成和結(jié)構(gòu):
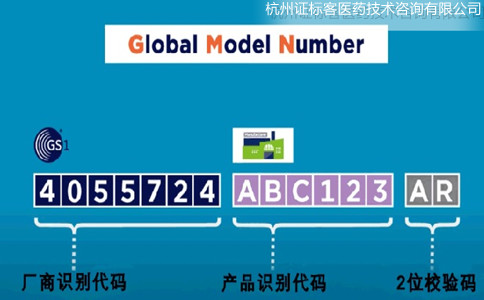
Basic UDI-DI是由Company Prefix + Model Reference+校驗碼組成,長度不能超過25位��。其中�,Company Prefix即廠商識別代碼,與UDI中的一致�����。Model Reference�����,也就是產(chǎn)品識別代碼����,是由企業(yè)自行編制的,可以是字母+數(shù)字的形式��。
二�、什么地方用到Basic-UDI?
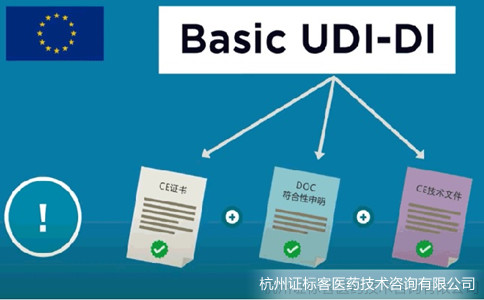
Basic UDI-DI是EUDAMED數(shù)據(jù)庫中關(guān)鍵信息�,同時會體現(xiàn)在CE證書、歐盟符合性聲明和技術(shù)文件中����。
寫這個有關(guān)歐盟Basic-UDI簡介��,是希望大家能更早應(yīng)對出口要求變化���,更多疑問,歡迎您隨時方便與杭州證標(biāo)客聯(lián)系����。