五一假期放假前一天��,藥監(jiān)總局發(fā)布了2023年修訂版《一次性使用血液分離器具注冊審查指導(dǎo)原則》��,一次性使用血液分離器具在我國屬于第三類醫(yī)療器械注冊?產(chǎn)品����,本指導(dǎo)原則旨在幫助和指導(dǎo)醫(yī)療器械注冊申請人對一次性使用血液分離器具產(chǎn)品注冊申報資料進(jìn)行準(zhǔn)備,同時也為技術(shù)審評部門提供參考�。
五一假期放假前一天,藥監(jiān)總局發(fā)布了2023年修訂版《一次性使用血液分離器具注冊審查指導(dǎo)原則》����,一次性使用血液分離器具在我國屬于第三類醫(yī)療器械注冊產(chǎn)品,本指導(dǎo)原則旨在幫助和指導(dǎo)醫(yī)療器械注冊申請人對一次性使用血液分離器具產(chǎn)品注冊申報資料進(jìn)行準(zhǔn)備����,同時也為技術(shù)審評部門提供參考。
一次性使用血液分離器具注冊審查指導(dǎo)原則(2023年修訂版)
本指導(dǎo)原則旨在幫助和指導(dǎo)醫(yī)療器械注冊申請人對一次性使用血液分離器具產(chǎn)品注冊申報資料進(jìn)行準(zhǔn)備���,同時也為技術(shù)審評部門提供參考��。
本指導(dǎo)原則是對一次性使用血液分離器具產(chǎn)品注冊申報資料的一般要求��,注冊申請人可依據(jù)具體產(chǎn)品的特性對注冊申報資料的內(nèi)容進(jìn)行充分說明和細(xì)化�。注冊申請人還可依據(jù)具體產(chǎn)品的特性確定其中的具體內(nèi)容是否適用�����,若不適用,需詳細(xì)闡述理由及相應(yīng)的科學(xué)依據(jù)�。
本指導(dǎo)原則是對注冊申請人和技術(shù)審評人員的指導(dǎo)性文件, 但不包括注冊審批所涉及的行政事項,亦不作為法規(guī)強(qiáng)制執(zhí)行, 如果有能夠滿足相關(guān)法規(guī)要求的其他方法���,也可以采用�����,但是需要提供詳細(xì)的研究資料和驗證資料�。應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導(dǎo)原則���。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制訂的,隨著法規(guī)和標(biāo)準(zhǔn)體系的不斷完善�����,以及科學(xué)技術(shù)的不斷發(fā)展���,本指導(dǎo)原則相關(guān)內(nèi)容也將進(jìn)行適時的調(diào)整���。
一、適用范圍
本指導(dǎo)原則適用于一次性使用血液分離器具產(chǎn)品的注冊�。
本指導(dǎo)原則適用的一次性使用血液分離器具產(chǎn)品主要是指與血液成分分離等有源設(shè)備配套使用�,用于人體血液成分分離的無源醫(yī)療器械�����,包括:一次性使用動靜脈穿刺器(與血液成分采集機(jī)配套使用)�����、一次性使用血液成分分離管路�、一次性使用血漿分離器、一次性使用血細(xì)胞分離器��、一次性使用血漿分離杯等����。
本指導(dǎo)原則不適用于儲存血液成分的器械(如:10-02-01一次性使用塑料血袋、血小板儲存袋)��、血液成分病原體滅活的器械(如:一次性使用病原體滅活輸血過濾器械)�����、用于血液凈化的器械(如:膜型血漿分離器)��、自體血液回輸器械�。
二����、注冊審查要點
(一)監(jiān)管信息
應(yīng)準(zhǔn)確填寫申報產(chǎn)品申請表�、產(chǎn)品列表、既往溝通記錄���、主文檔授權(quán)信以及其它管理信息等��。
(二)綜述資料
1.概述
描述申報產(chǎn)品的管理類別��、分類編碼及名稱的確定依據(jù)����。產(chǎn)品應(yīng)符合《醫(yī)療器械分類目錄》中10輸血�����、透析和體外循環(huán)器械目錄下02血液分離���、處理、貯存器具項下的02離心式血液成分分離器�����、03 動靜脈穿刺器(與血液成分采集機(jī)配套使用)、06血漿管路���。管理類別為第三類����。
2.產(chǎn)品及工作原理描述
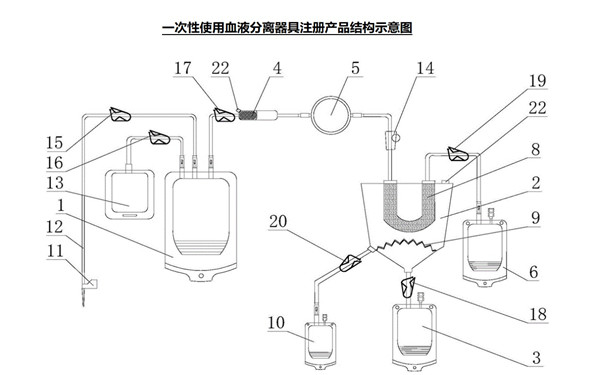
(1)產(chǎn)品描述
產(chǎn)品描述應(yīng)準(zhǔn)確��、完整����,至少應(yīng)包括申報產(chǎn)品名稱、各組件名稱�����、所用原材料(使用規(guī)范化學(xué)名稱)�����、結(jié)構(gòu)(相應(yīng)圖示)����、預(yù)期用途(明確預(yù)期采集、分離和處理的目標(biāo)血液成分種類和數(shù)量)�、預(yù)期使用的機(jī)構(gòu)(漿站�、血站或其他機(jī)構(gòu))����、預(yù)期適用范圍(健康捐獻(xiàn)者、治療患者)���、配合使用的有源器械�。
(2)產(chǎn)品工作原理
申請人應(yīng)詳細(xì)闡明申報器械分離血液成分的工作機(jī)理���,描述產(chǎn)品分離血液成分的過程���,建議配以圖示做具體說明。必要時�,提交支持該分離原理的文獻(xiàn)綜述。
3.型號規(guī)格
說明產(chǎn)品的規(guī)格型號及劃分依據(jù)��,明確各規(guī)格型號之間的區(qū)別��?��?刹捎昧斜硇问綄Σ煌?guī)格型號的結(jié)構(gòu)組成、性能指標(biāo)等加以描述�����,必要時應(yīng)提供差異部分的圖示說明。
4.包裝說明
應(yīng)包括產(chǎn)品各層次包裝信息�,提供產(chǎn)品實物照片或示意圖。明確說明產(chǎn)品各層次包裝所用原材料信息����。應(yīng)當(dāng)說明其無菌屏障系統(tǒng)的信息、提供正確包裝的信息(如材料����、成分和尺寸等)。
5.研發(fā)歷程
闡述申請注冊產(chǎn)品的研發(fā)背景和目的�。如有參考的同類產(chǎn)品或前代產(chǎn)品,應(yīng)當(dāng)提供同類產(chǎn)品或前代產(chǎn)品的信息���,并說明選擇其作為研發(fā)參考的原因���。
6.與同類和/或前代產(chǎn)品的參考和比較
申請人應(yīng)綜述同類產(chǎn)品國內(nèi)外研究及臨床使用現(xiàn)狀及發(fā)展趨勢。描述本次申報器械與已上市同類器械的相似點和不同點�,建議以列表方式表述,比較的項目應(yīng)包括產(chǎn)品名稱�、結(jié)構(gòu)組成、工作機(jī)理、預(yù)期用途和使用環(huán)境�����、原材料�����、生產(chǎn)工藝����、滅菌方式、性能指標(biāo)��、有效期����、配套有源設(shè)備、已上市國家或地區(qū)等�。包括本企業(yè)已上市同類產(chǎn)品或其他企業(yè)已上市同類產(chǎn)品。
7.適用范圍和禁忌證
(1)適用范圍
適用范圍需明確預(yù)期與其配合使用的有源設(shè)備(如適用)����、具體預(yù)期用途。例如�����,產(chǎn)品與血液成分分離機(jī)配套使用����,用于人體血液成分的采集、分離和貯存���。
(2)預(yù)期使用環(huán)境
明確該產(chǎn)品預(yù)期使用的地點���,如醫(yī)療機(jī)構(gòu)、血站等����。明確可能影響其安全性和有效性的環(huán)境條件,如溫度�、濕度、振動等�。
(3)禁忌證
如適用,應(yīng)當(dāng)明確說明該器械不適宜應(yīng)用的特定情況等信息��。
(三)非臨床資料
至少應(yīng)包含如下內(nèi)容:
1.產(chǎn)品風(fēng)險管理資料
按照GB/T 42062《醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用》標(biāo)準(zhǔn)的要求�����,申請人應(yīng)對產(chǎn)品生命周期全過程實施風(fēng)險管理,提交完整的風(fēng)險管理報告�。
應(yīng)當(dāng)提供產(chǎn)品風(fēng)險分析、風(fēng)險評價����、風(fēng)險控制、任何一個或多個剩余風(fēng)險的可接受性評定�����,以及與產(chǎn)品受益相比綜合評價套包風(fēng)險可接受的文件���,并說明對于每項已判定危害的下列各個過程的可追溯性�。
風(fēng)險分析可從設(shè)計�、防護(hù)措施、說明書����、標(biāo)簽等方面進(jìn)行考慮。申請人可通過產(chǎn)品設(shè)計控制�����、原材料選擇���、性能指標(biāo)的制定���、臨床使用、正確的標(biāo)簽標(biāo)識���、滅菌等多項措施以降低風(fēng)險至可接受水平��,常見風(fēng)險因素包括但不限于:
(1)產(chǎn)品設(shè)計不合理����、使用生物不相容材料���、與配套器械不具有良好適配性等導(dǎo)致分離出的成分血不符合醫(yī)療衛(wèi)生機(jī)構(gòu)使用標(biāo)準(zhǔn)����;
(2)使用生物不相容材料�、滅菌不符合要求、包裝損壞造成生物污染等導(dǎo)致捐獻(xiàn)者血液成分回輸過程中或回輸血后的不良反應(yīng)(如:發(fā)熱��、過敏�����、敗血癥等)或者毒副作用。
(3)使用生物不相容材料導(dǎo)致溶血�;
(4)凝血;
(5)血栓形成�;
(6)紅細(xì)胞破壞、補(bǔ)體激活�����、蛋白質(zhì)變性����;
(7)組件匹配不適當(dāng)及操作不當(dāng)導(dǎo)致靜脈系統(tǒng)與大氣相通,發(fā)生氣泡栓塞�;
(8)管路連接錯誤;
(9)分離過程中泄漏�����,對于捐獻(xiàn)者或操作者有感染疾病的風(fēng)險�����;
(10)分離過程中泄漏�����,導(dǎo)致血液流失;
(11)污染組件處理不當(dāng)造成生物污染及交叉感染����;
(12)不當(dāng)操作使產(chǎn)品暴露在高于標(biāo)示的壓力中,導(dǎo)致泄漏����。
(13)產(chǎn)品過敏反應(yīng)�,如:鎳過敏。
2.醫(yī)療器械安全和性能基本原則清單
說明一次性使用血液分離器具產(chǎn)品符合《醫(yī)療器械安全和性能基本原則清單》各項適用要求所采用的方法�����,以及證明其符合性的文件�。對于不適用的各項要求,應(yīng)當(dāng)說明理由����。
3.產(chǎn)品技術(shù)要求及檢驗報告
申請人應(yīng)根據(jù)產(chǎn)品的技術(shù)特征和臨床使用情況來確定產(chǎn)品安全有效的技術(shù)要求與試驗方法,技術(shù)指標(biāo)應(yīng)不低于相關(guān)的國家標(biāo)準(zhǔn)或行業(yè)標(biāo)準(zhǔn)(YY 0584《一次性使用離心杯式血液成分分離器》�、YY 0613《一次性使用離心袋式血液成分分離器》、YY/T 0328《一次性使用動靜脈穿刺器》等)��,對申請人在說明書中標(biāo)示的技術(shù)參數(shù)和功能��,必要時應(yīng)在產(chǎn)品技術(shù)要求中予以規(guī)定。
產(chǎn)品技術(shù)要求應(yīng)至少包括以下內(nèi)容:
(1)產(chǎn)品各組成部件及所用原材料��,產(chǎn)品結(jié)構(gòu)圖示����、尺寸;
(2)列明每一規(guī)格型號���,并闡明各規(guī)格型號之間的區(qū)別和劃分依據(jù)��;
(3)產(chǎn)品性能要求及試驗方法����、產(chǎn)品滅菌方法�、有效期等。
應(yīng)考慮的性能要求主要包括但不限于以下內(nèi)容:外觀����、尺寸、容量�����、耐壓��、泄漏、泵管彈性��、膜的孔徑�����、過濾性能����、微粒污染、摩擦熱量����、噪音����、血液殘留、通氣性��、阻血性���、適配性���、生物性能(無菌���、細(xì)菌內(nèi)毒素)、粘合劑的溶出����、環(huán)氧乙烷殘留量、擬預(yù)期分離的成分血的質(zhì)量控制指標(biāo)等���。含特殊組件的產(chǎn)品�,如:去白細(xì)胞濾器需同時滿足行業(yè)標(biāo)準(zhǔn)的相關(guān)要求(如:殘留白細(xì)胞數(shù)�����、游離血紅蛋白�、紅細(xì)胞/血小板回收率等),如有采血前留樣裝置����,應(yīng)至少制定容量、平均流速�����、防回流、無菌采樣設(shè)計等性能指標(biāo)�。
4.產(chǎn)品檢驗報告
所檢測型號產(chǎn)品應(yīng)當(dāng)是本注冊單元內(nèi)能夠代表申報的其他型號產(chǎn)品安全性和有效性的典型產(chǎn)品。
應(yīng)根據(jù)所申報產(chǎn)品的特點�,從影響產(chǎn)品安全性、有效性的原材料���、生產(chǎn)工藝�、性能指標(biāo)等方面說明產(chǎn)品的典型性����。
5.研究資料
根據(jù)申報產(chǎn)品適用范圍和技術(shù)特征,提供非臨床研究綜述��,逐項描述所開展的研究����,概述研究方法和研究結(jié)論����。根據(jù)非臨床研究綜述,提供相應(yīng)的研究資料����,主要包括以下方面:
(1)產(chǎn)品性能研究
申請人應(yīng)明確與申報產(chǎn)品相關(guān)的性能要求,需提供產(chǎn)品性能研究資料,包括有效性����、安全性指標(biāo)以及與質(zhì)量控制相關(guān)的其他指標(biāo)的確定依據(jù),所采用的標(biāo)準(zhǔn)或方法�、采用的理由及理論基礎(chǔ)。需根據(jù)產(chǎn)品的性能特點和臨床應(yīng)用���,制定適合產(chǎn)品的技術(shù)指標(biāo)并說明依據(jù)�����。
與配套使用的有源器械和/或儲存血液成分的器械聯(lián)合使用���,對于健康捐獻(xiàn)者,按規(guī)定的操作規(guī)程進(jìn)行血液成分分離后�,成分血的質(zhì)量控制指標(biāo)應(yīng)至少符合國家衛(wèi)生健康委員會相關(guān)法規(guī)對成分血的要求,如GB 18469《全血及成分血質(zhì)量要求》對成分血的質(zhì)量控制要求�����。例如:濃縮紅細(xì)胞的質(zhì)量控制指標(biāo)至少包括:外觀���、容量���、血細(xì)胞比容�、血紅蛋白含量��、儲存期末溶血率����、儲存期末pH值、無菌試驗�����;單采血小板的質(zhì)量控制指標(biāo)至少包括:外觀��、容量���、儲存期末pH值����、血小板含量�、白細(xì)胞混入量�����、紅細(xì)胞混入量、無菌試驗����;單采新鮮冰凍血漿的質(zhì)量控制指標(biāo)至少包括:外觀、容量���、血漿蛋白含量��、Ⅷ因子含量����、無菌試驗��;單采粒細(xì)胞的質(zhì)量控制指標(biāo)至少包括:外觀��、容量���、中性粒細(xì)胞含量����、紅細(xì)胞混入量����、無菌試驗等����。
如申報產(chǎn)品有其他特殊用途��,應(yīng)提供其與有源設(shè)備配合使用時血液成分分離效果研究資料�����。
(2)原材料控制
材料特性是產(chǎn)品最終質(zhì)量控制的重要因素�����。申請人應(yīng)提交原材料的質(zhì)控資料及材料在生產(chǎn)加工中可能產(chǎn)生或殘留引起機(jī)體反應(yīng)的有毒物質(zhì)的相關(guān)研究報告����。
應(yīng)列明產(chǎn)品各部件所對應(yīng)原材料(包括產(chǎn)品標(biāo)簽粘貼劑、染料/顏料�����、潤滑劑)的化學(xué)名稱�����、商品名/材料代號���、化學(xué)結(jié)構(gòu)式/分子式�、分子量及分子量分布����、供應(yīng)商名稱、符合的標(biāo)準(zhǔn)等基本信息����,建議以列表的形式提供。
說明原材料的選擇依據(jù)及來源�。提交原材料符合相應(yīng)標(biāo)準(zhǔn)的研究資料。對于首次應(yīng)用于醫(yī)療器械的新材料�����,應(yīng)提供該材料適合用于人體預(yù)期使用部位����、預(yù)期使用方式的相關(guān)研究資料。
(3)生物學(xué)特性研究
建議按照產(chǎn)品與人體的接觸性質(zhì)和接觸時間來選擇合適的生物學(xué)評價方法����。生物學(xué)特性研究建議按照GB/T 16886.1《醫(yī)療器械生物學(xué)評價 第1部分:風(fēng)險管理過程中的評價與試驗》、GB/T 16886.4《醫(yī)療器械生物學(xué)評價 第4部分:與血液相互作用試驗選擇》等相關(guān)要求進(jìn)行�����。
(4)滅菌研究
提交產(chǎn)品滅菌方法的選擇依據(jù)及驗證報告。器械的滅菌應(yīng)通過GB 18278.1《醫(yī)療保健產(chǎn)品滅菌 濕熱 第1部分 醫(yī)療器械滅菌過程的開發(fā)����、確認(rèn)和常規(guī)》或GB 18280《醫(yī)療保健產(chǎn)品滅菌輻射》系列標(biāo)準(zhǔn)、GB 18279《醫(yī)療保健產(chǎn)品滅菌 環(huán)氧乙烷》系列標(biāo)準(zhǔn)確認(rèn)并進(jìn)行常規(guī)控制����,無菌保證水平應(yīng)保證(SAL)達(dá)到1×10-6。滅菌過程的選擇應(yīng)至少考慮以下因素:產(chǎn)品與滅菌過程的適應(yīng)性����;包裝材料與滅菌過程的適應(yīng)性。
若滅菌使用的方法容易出現(xiàn)殘留����,如環(huán)氧乙烷滅菌,應(yīng)當(dāng)明確殘留物信息及采取的處理方法�,并提供研究資料。
6.穩(wěn)定性研究
(1)貨架有效期
產(chǎn)品貨架有效期包括產(chǎn)品有效期和包裝有效期����。產(chǎn)品有效期驗證可采用加速老化或?qū)崟r老化的研究。在進(jìn)行加速老化試驗研究時應(yīng)注意:產(chǎn)品選擇的環(huán)境條件的老化機(jī)制應(yīng)與在實時正常使用環(huán)境老化條件下真實發(fā)生產(chǎn)品老化的機(jī)制一致。
對于包裝的有效期驗證���,建議申請人提交最終成品包裝的初始完整性和維持完整性的檢測結(jié)果�����。
產(chǎn)品包裝驗證可依據(jù)有關(guān)標(biāo)準(zhǔn)進(jìn)行,如GB/T 19633《最終滅菌醫(yī)療器械包裝》系列標(biāo)準(zhǔn)��、YY/T 0681《無菌醫(yī)療器械包裝試驗方法》系列標(biāo)準(zhǔn)�����、YY/T 0698《最終滅菌醫(yī)療器械包裝材料》系列標(biāo)準(zhǔn)等�。
(2)運(yùn)輸穩(wěn)定性
應(yīng)當(dāng)提供運(yùn)輸穩(wěn)定性和包裝研究資料,證明在生產(chǎn)企業(yè)規(guī)定的運(yùn)輸條件下(如適宜的溫度�、濕度、震動�、振動、壓力等)��,運(yùn)輸過程不會對醫(yī)療器械的特性和性能����,包括完整性和清潔度,造成不利影響����。
(四)臨床評價資料
該類產(chǎn)品不屬于免于進(jìn)行臨床評價目錄內(nèi)產(chǎn)品����。在滿足注冊法規(guī)要求的前提下��,可按照《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》進(jìn)行臨床評價����。
(五)產(chǎn)品說明書和標(biāo)簽樣稿
產(chǎn)品說明書、標(biāo)簽和包裝標(biāo)識應(yīng)符合《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》及相關(guān)行業(yè)標(biāo)準(zhǔn)(如YY 0584《一次性使用離心杯式血液成分分離器》���、YY 0613《一次性使用離心袋式血液成分分離器》等)的要求����。同時����,說明書還應(yīng)包含以下內(nèi)容:
1.產(chǎn)品名稱;
2.產(chǎn)品的通用描述���,包括產(chǎn)品特征����,產(chǎn)品規(guī)格型號或生產(chǎn)企業(yè)器件識別代碼。明確產(chǎn)品的適用范圍����、預(yù)期使用環(huán)境、禁忌證�、注意事項,并與臨床評價結(jié)果和報告保持一致��;
3.產(chǎn)品有效期限�;
4.針對產(chǎn)品特點的特殊注意事項與警示信息�����,如:必須標(biāo)注配套使用產(chǎn)品的信息�����、包裝破損禁止使用;
5.可能發(fā)生的不良反應(yīng)與處理預(yù)防措施���;
6.滅菌方式����;
7.一次性使用的聲明;
8.產(chǎn)品的性能參數(shù)����;
9.產(chǎn)品使用流程圖,包括用品準(zhǔn)備�����、操作準(zhǔn)備����、操作過程、后處理�,及異常情況處理等;
10.關(guān)于兒童或特定人群禁止使用或使用方法的警示及說明���;
11.應(yīng)有“使用前請閱讀使用說明書”的文字說明����。
12.關(guān)于使用后處理及貯存的警示及說明�。使用后處理應(yīng)至少標(biāo)示“產(chǎn)品使用后應(yīng)按《醫(yī)療廢物管理條例》的規(guī)定進(jìn)行處理”。
13.說明書中明確標(biāo)示“產(chǎn)品使用必須符合醫(yī)療部門相關(guān)操作規(guī)范及相關(guān)法規(guī)的要求”或類似的警示性語言����。
(六)質(zhì)量管理體系文件
按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》要求提交資料�����,包括但不局限于以下內(nèi)容:
1.生產(chǎn)工藝及控制
提交產(chǎn)品的生產(chǎn)工藝驗證��、過程控制的體系管理文件���,詳細(xì)說明產(chǎn)品的生產(chǎn)工藝和步驟,列出工藝圖表�����。提交生產(chǎn)工藝過程中驗證和控制文件���,確認(rèn)關(guān)鍵工藝點并闡明其對產(chǎn)品物理性能、化學(xué)性能���、機(jī)械性能��、生物性能等的影響����。
2.生產(chǎn)場地
有多個研制�����、生產(chǎn)場地,應(yīng)當(dāng)概述每個研制�、生產(chǎn)場地的實際情況。
三�����、參考文獻(xiàn)
[1]中華人民共和國國務(wù)院.醫(yī)療器械監(jiān)督管理條例: 中華人民共和國國務(wù)院令第739號[Z].
[2]國家市場監(jiān)督管理總局.醫(yī)療器械注冊與備案管理辦法: 國家市場監(jiān)督管理總局令第47號[Z].
[3]國家藥品監(jiān)督管理局.關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告: 國家藥品監(jiān)督管理局2021年第121號[Z].
[4]國家藥品監(jiān)督管理局 國家衛(wèi)生健康委員會.醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范: 國家藥品監(jiān)督管理局 國家衛(wèi)生健康委員會2022年第28號[Z].
[5]原國家食品藥品監(jiān)督管理總局.醫(yī)療器械說明書和標(biāo)簽管理規(guī)定: 國家食品藥品監(jiān)督管理總局令第6號[Z].
[6]原國家食品藥品監(jiān)督管理總局.醫(yī)療器械分類目錄: 國家食品藥品監(jiān)督管理總局2017年第104號[Z].
[7]原國家食品藥品監(jiān)督管理總局.醫(yī)療器械注冊單元劃分指導(dǎo)原則: 國家食品藥品監(jiān)督管理總局通告2017年第187號[Z].
[8]國家藥品監(jiān)督管理局.醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則:國家藥品監(jiān)督管理局2021年第73號[Z].
[9]Guidance for Industry:Recommendations for Collecting Red Blood Celles by Automated Apheresis Methods�;January 2001 ,CBER US FDA[S].
[10]Guidance for Industry and FDA Staff:Class II Special Controls Guidance Docunment:Automated Blood Cell Separator Device Operating by Centrifugal or Filtration Separation Principle;November 2007,Updated March 2011 ,CBER US FDA[S].
[11]GB/T 42062-2022����,醫(yī)療器械 風(fēng)險管理對醫(yī)療器械的應(yīng)用[S].
[12]YY 0584-2005,一次性使用離心杯式血液成分分離器[S].
[13]YY 0613-2007���,一次性使用離心袋式血液成分分離器[S].
[14]YY/T 0328-2015�����,一次性使用動靜脈穿刺器[S]
[15]GB 18469-2012����,全血及成分血質(zhì)量要求[S].
[16]GB/T 16886.1-2022���,醫(yī)療器械生物學(xué)評價 第1部分:風(fēng)險管理過程中的評價與試驗[S].
[17]GB/T 16886.4-2022��,醫(yī)療器械生物學(xué)評價 第4部分:與血液相互作用試驗選擇[S].
[18]GB 18278.1-2015���,醫(yī)療保健產(chǎn)品滅菌 濕熱 第1部分 醫(yī)療器械滅菌過程的開發(fā)��、確認(rèn)和常規(guī)控制要求[S].
[19]GB 18280.1-2015����,醫(yī)療保健產(chǎn)品滅菌 輻射 第1部分:醫(yī)療器械滅菌過程的開發(fā)��、確認(rèn)和常規(guī)控制要求[S].
[20]GB 18279.1-2015�����,醫(yī)療保健產(chǎn)品滅菌 環(huán)氧乙烷滅菌第1部分:醫(yī)療器械滅菌過程的開發(fā)�、確認(rèn)和常規(guī)控制的要求[S].
[21]GB/T 19633.1-2015�����,最終滅菌醫(yī)療器械包裝 第1部分:材料���、無菌屏障系統(tǒng)和包裝系統(tǒng)的要求[S].
[22]YY/T 0681.1-2018����,無菌醫(yī)療器械包裝試驗方法 第1部分:加速老化試驗指南[S].
[23]YY/T 0698.1-2011,最終滅菌醫(yī)療器械包裝材料 第1部分:吸塑包裝共擠塑料膜 要求和試驗方法[S].