2023年4月28日��,上海市藥品監(jiān)督管理局發(fā)布2022年度第二類有源醫(yī)療器械首次注冊技術(shù)審評常見問題分析����,2022年上海市醫(yī)療器械化妝品審評核查中心共計受理第二類有源醫(yī)療器械首次注冊92件,其中91件進(jìn)行了發(fā)補(bǔ),最常見的問題為:產(chǎn)品技術(shù)要求�����、研究資料�����、綜述資料���。一起來了解上海市第二類有源醫(yī)療器械注冊審評常見問題有哪些�����。
2023年4月28日���,上海市藥品監(jiān)督管理局發(fā)布2022年度第二類有源醫(yī)療器械首次注冊技術(shù)審評常見問題分析,2022年上海市醫(yī)療器械化妝品審評核查中心共計受理第二類有源醫(yī)療器械首次注冊92件���,其中91件進(jìn)行了發(fā)補(bǔ)���,最常見的問題為:產(chǎn)品技術(shù)要求、研究資料���、綜述資料�����。一起來了解上海市第二類有源醫(yī)療器械注冊審評常見問題有哪些��。
一�����、上海第二類醫(yī)療器械注冊(首次注冊)審評發(fā)補(bǔ)意見分布情況
91件首次注冊發(fā)補(bǔ)涉及68家企業(yè)�����,發(fā)補(bǔ)意見主要集中在綜述資料�����、研究資料�����、臨床評價����、產(chǎn)品技術(shù)要求和產(chǎn)品說明書五部分(見圖一),其中綜述資料發(fā)補(bǔ)率67%�����,研究資料發(fā)補(bǔ)率90.2%���,臨床評價發(fā)補(bǔ)率62%����,產(chǎn)品技術(shù)要求發(fā)補(bǔ)率93%���,產(chǎn)品說明書發(fā)補(bǔ)率62%��。
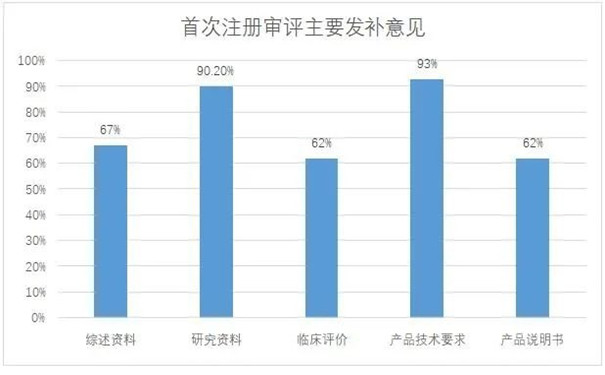
圖一:首次注冊審評主要發(fā)補(bǔ)意見分布情況
二�����、首次注冊審評常見問題分析
1�����、注冊單元及產(chǎn)品管理類別問題
根據(jù)《醫(yī)療器械注冊單元劃分指導(dǎo)原則》����,產(chǎn)品技術(shù)原理、結(jié)構(gòu)組成�����、性能指標(biāo)���、適用范圍不同時��,原則上劃分為不同注冊單元���。例如電子鼻咽喉鏡,需要詳述不同型號的差異���,包括原材料、結(jié)構(gòu)組成等����,用于判斷是否為同一注冊單元。部分產(chǎn)品管理類別不明確�,有些產(chǎn)品屬于三類醫(yī)療器械或不屬于醫(yī)療器械,需進(jìn)行分類界定����,建議企業(yè)在提交資料前進(jìn)行分類界定明確產(chǎn)品管理類別���。
2、綜述資料常見問題
企業(yè)應(yīng)當(dāng)根據(jù)《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》�����,編寫申報產(chǎn)品的綜述資料�����,存在主要問題如下:
(1)產(chǎn)品作用機(jī)理:未詳細(xì)描述產(chǎn)品的工作原理��,未提供產(chǎn)品的工作原理圖�,未描述功能的具體實現(xiàn)方式;產(chǎn)品原理的描述與產(chǎn)品檢驗報告中的描述不一致��。
(2)結(jié)構(gòu)組成:未明確具體描述產(chǎn)品的結(jié)構(gòu)組成(包括附件����、選配件);未提供各部件的詳細(xì)規(guī)格����;未提供內(nèi)部結(jié)構(gòu)示意圖和電路圖及說明(如,部件照片�、軟件的界面�、功能����、輸出報告描述);產(chǎn)品結(jié)構(gòu)組成與提供的產(chǎn)品照片中的組成不一致���;未對不同型號的產(chǎn)品在結(jié)構(gòu)組成上的差異進(jìn)行詳細(xì)描述����。
(3)型號規(guī)格:未明確申報的產(chǎn)品型號和包含的部件型號之同的配置關(guān)系��;對于存在多型號規(guī)格(配置)的產(chǎn)品�,未明確產(chǎn)品型號劃分、未明確各型號規(guī)格的區(qū)別和差異(如:結(jié)構(gòu)����、功能�、性能指標(biāo)等);對申報產(chǎn)品中在結(jié)構(gòu)特征上有明顯區(qū)別的產(chǎn)品���,企業(yè)未在產(chǎn)品型號命名規(guī)則上予以區(qū)分���。
(4)適用范圍:未明確適用范圍�����;產(chǎn)品適用范圍超出《醫(yī)療器械分類目錄》中對于相應(yīng)分類的描述���;產(chǎn)品適用范圍的表述與配用主機(jī)的適用范圍表述不一致;特定產(chǎn)品適用范圍的內(nèi)容中未明確適用人群的范圍��,如年齡�����、體重等要求��。
(5)軟件相關(guān):軟件功能表述不清晰��,相關(guān)功能的臨床用途和意義不明確��;未按照軟件指導(dǎo)原則規(guī)范制定軟件發(fā)布版本與版本軟件命名規(guī)則��;未明確軟件算法���、數(shù)學(xué)模型的原理和臨床依據(jù)����,包括計算分析處理過程等內(nèi)容;軟件描述文檔未按照《醫(yī)療器械軟件注冊審查技術(shù)指導(dǎo)原則》(2022年修訂版)進(jìn)行完善�����;未詳細(xì)描述軟件所有的交付內(nèi)容和形式�����;未對軟件安裝和部署方式進(jìn)行介紹���;未詳細(xì)描述軟件架構(gòu)(如BS���、CS)的實現(xiàn)方式;未對軟件中使用的現(xiàn)成軟件進(jìn)行介紹�����。
3�、研究資料常見問題
(1)性能研究:提供的產(chǎn)品性能指標(biāo)、產(chǎn)品技術(shù)要求的編制說明的確定依據(jù)不清晰不明確���;強(qiáng)制性標(biāo)準(zhǔn)內(nèi)容引用不完整,對不適用條款未給出不適用的理由;例如心電記錄儀未詳細(xì)說明產(chǎn)品對強(qiáng)制性標(biāo)準(zhǔn)YY0885各條款的符合性�����,未對不適用條款給出理由����。
(2)軟件研究:應(yīng)按照《醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版)》《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版)》提交產(chǎn)品軟件研究資料和網(wǎng)絡(luò)安全資料,存在主要問題如下:①未對軟件安全級別進(jìn)行詳細(xì)描述�,安全級別判定理由不合理,未根據(jù)軟件安全性級別提交相應(yīng)資料��;②軟件核心功能�、核心算法描述過于簡單,缺少測量準(zhǔn)確性研究和驗證資料����;③軟件描述文檔中軟件版本信息與檢驗報告不一致。④錯誤認(rèn)定產(chǎn)品不含軟件或不涉及網(wǎng)絡(luò)安全��。
(3)生物學(xué)研究:研究存在的主要問題有:未考慮微生物性能����,未明確與患者及使用者接觸部件的材料性質(zhì)等。
(4)有效期和包裝研究:存在的主要問題有:未根據(jù)產(chǎn)品特點(diǎn)合理選擇使用期限評價路徑����,評價方法不清晰�;有效期研究資料中未見部分不可更換部件使用壽命相關(guān)資料�。
4、臨床評價資料常見問題
(1)免臨床評價目錄(以下簡稱目錄)內(nèi)產(chǎn)品:與境內(nèi)已注冊產(chǎn)品的對比不全面����,未考慮主要性能指標(biāo)、軟件功能等方面差異����;對工作原理、結(jié)構(gòu)組成�、實現(xiàn)方式等顯著性差異分析不充分,不能證明兩者具有基本等同性����;缺少對比產(chǎn)品注冊批件或說明書等支持性資料。
(2)通過同品種器械開展評價:如提交的同品種產(chǎn)品臨床數(shù)據(jù)欠缺可比性和充分性�,未充分考慮適用范圍、技術(shù)特征以及生物學(xué)特性的差異���,不能證明兩者具有廣泛相似性���;提交的臨床文獻(xiàn)中缺少同品種產(chǎn)品信息�,未說明兩者相關(guān)性����;臨床文獻(xiàn)無實質(zhì)內(nèi)容�,也未開展對比測試或驗證;未對文獻(xiàn)數(shù)據(jù)進(jìn)行分析�����,也未評估其對申報產(chǎn)品性能與安全性論證的貢獻(xiàn)����。
(3)通過臨床試驗開展評價:如臨床試驗過程中對申報器械的使用操作與產(chǎn)品說明書不完全一致,未給出解釋����;適用范圍描述有待規(guī)范,臨床試驗評價指標(biāo)與企業(yè)主張的臨床適用范圍有顯著差異���;有效性評價采用評分表形式���,但未提供確立依據(jù);未對剔除病例��、離群值進(jìn)行合理分析;適應(yīng)癥表述不清晰不明確�����,未闡述不同病種病例數(shù)的統(tǒng)計學(xué)考慮�����。
5�����、產(chǎn)品技術(shù)要求常見問題
產(chǎn)品技術(shù)要求遵循的原則有《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》�、適用的強(qiáng)制性國家/行業(yè)標(biāo)準(zhǔn)、推薦性國家/行業(yè)標(biāo)準(zhǔn)(推薦采用)��。產(chǎn)品技術(shù)要求存在問題:
(1)缺少部分性能指標(biāo)����、指標(biāo)不合理;
(2)缺少軟件功能����,軟件功能描述不清晰;
(3)軟件版本�����、命名規(guī)則不完整、缺少典型運(yùn)行環(huán)境����;
(4)附錄中缺少必要的內(nèi)容��,如缺少非標(biāo)體模�,工裝、測試軟件等信息���;
(5)檢驗方法不合理����,不明確���;
(6)編寫不規(guī)范���,如缺少標(biāo)準(zhǔn)年代號、未按最新版《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》編寫�����;
(7)引用標(biāo)準(zhǔn)的問題,如標(biāo)準(zhǔn)條款引用不全���,未識別出產(chǎn)品適用的標(biāo)準(zhǔn)���;
(8)結(jié)構(gòu)組成不完整、型號規(guī)格劃分不清晰����。
6、產(chǎn)品說明書常見問題
醫(yī)療器械產(chǎn)品說明書可參考以下具體文件《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》�����、標(biāo)準(zhǔn)(強(qiáng)標(biāo)�����、專標(biāo))及注冊技術(shù)審查指導(dǎo)原則對說明書的要求��。常見問題如下:
(1)說明書中描述內(nèi)容與綜述資料��、研究資料不一致���;
(2)說明書中性能指標(biāo)與產(chǎn)品技術(shù)要求不一致�����;
(3)未涵蓋《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》中要求的內(nèi)容或描述不清晰�。
(4)說明書內(nèi)容未在技術(shù)要求中體現(xiàn)
(5)未涵蓋注冊技術(shù)審查指導(dǎo)原則及國標(biāo)行標(biāo)中要求的內(nèi)容。
7��、醫(yī)療器械注冊檢驗報告常見問題
送檢樣品應(yīng)為成品��,檢驗報告上條款應(yīng)與產(chǎn)品技術(shù)要求一致�����,并在具備醫(yī)療器械檢驗資質(zhì)的檢驗機(jī)構(gòu)進(jìn)行注冊檢驗�。常見問題如下:
(1)送檢樣品不能覆蓋所有型號規(guī)格����,除選擇典型型號進(jìn)行全性能檢驗外,還應(yīng)選擇其他型號進(jìn)行差異性檢驗��;
(2)提交的經(jīng)檢測機(jī)構(gòu)蓋章的產(chǎn)品技術(shù)要求與注冊提交的產(chǎn)品技術(shù)要求不一致���。
(3)以注冊人形式申報的產(chǎn)品�����,檢驗報告中的制造商與申報資料不一致��。
三��、 對上海市第二類有源醫(yī)療器械首次注冊的建議
本文對2022年上海市第二類有源醫(yī)療器械首次注冊常見發(fā)補(bǔ)問題進(jìn)行了梳理與分析����,其中最常見的問題為:產(chǎn)品技術(shù)要求、研究資料���、綜述資料�����。
在產(chǎn)品技術(shù)要求部分��,應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》撰寫產(chǎn)品技術(shù)要求�����,注重產(chǎn)品技術(shù)要求編寫的規(guī)范性���。醫(yī)療器械產(chǎn)品應(yīng)當(dāng)符合醫(yī)療器械強(qiáng)制性國家標(biāo)準(zhǔn)和強(qiáng)制性行業(yè)標(biāo)準(zhǔn)。產(chǎn)品技術(shù)要求中包含的性能指標(biāo)要完善,并覆蓋產(chǎn)品的功能����,否則可能會涉及補(bǔ)檢。
關(guān)于研究資料�,建議企業(yè)根據(jù)《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》進(jìn)行編寫,根據(jù)申報產(chǎn)品適用范圍和技術(shù)特征�����,提供研究綜述�,逐項描述所開展的研究,提供相應(yīng)的研究資料�����。研究資料應(yīng)當(dāng)包括產(chǎn)品性能指標(biāo)的確定依據(jù)�����、設(shè)計輸入來源等內(nèi)容�。研究資料應(yīng)當(dāng)足夠充分�,能夠證明產(chǎn)品的安全性和有效性。特別對于包含軟件組件的產(chǎn)品�����,應(yīng)當(dāng)根據(jù)《醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版)》的要求提交產(chǎn)品軟件研究資料,如涉及網(wǎng)絡(luò)安全�,還應(yīng)根據(jù)《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版)》的要求提供相應(yīng)網(wǎng)絡(luò)安全研究資料。
綜述資料部分��,企業(yè)應(yīng)當(dāng)詳細(xì)描述產(chǎn)品的工作原理��、結(jié)構(gòu)組成�����、適用范圍����、功能的具體實現(xiàn)方式等內(nèi)容,讓審評人員對產(chǎn)品能有整體的把握和了解�����,使產(chǎn)品的風(fēng)險能更清晰地被識別���。
關(guān)于說明書和標(biāo)簽��,企業(yè)應(yīng)認(rèn)真研讀《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》���,按規(guī)定編制說明書和標(biāo)簽�,規(guī)范表述產(chǎn)品規(guī)格型號��、適用范圍�、適用人群、注意事項和禁忌癥等���。說明書與研究資料�、產(chǎn)品技術(shù)要求等其他申報資料的內(nèi)容要保持一致����。