2023年10月25日���,國家藥監(jiān)局發(fā)布《中醫(yī)脈診設(shè)備產(chǎn)品注冊審查指導原則(征求意見稿)》���,相比2016年天津藥監(jiān)局發(fā)布的指導原則�����,此版本變動較大����,特別是允許采用同品種比對臨床評價方式完成中醫(yī)脈診設(shè)備的的臨床評價����,一起看正文。
2023年10月25日���,國家藥監(jiān)局發(fā)布《中醫(yī)脈診設(shè)備產(chǎn)品注冊審查指導原則(征求意見稿)》�����,相比2016年天津藥監(jiān)局發(fā)布的指導原則�����,此版本變動較大���,特別是允許采用同品種比對臨床評價方式完成中醫(yī)脈診設(shè)備的的臨床評價,一起看正文。
中醫(yī)脈診設(shè)備產(chǎn)品注冊審查指導原則(征求意見稿)
本指導原則旨在指導注冊申請人對中醫(yī)脈診設(shè)備注冊申報資料的準備及撰寫�,同時也為技術(shù)審評部門審查注冊申報資料提供參考�。
本指導原則是對中醫(yī)脈診設(shè)備的一般要求,申請人應(yīng)依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用�。若不適用,需具體闡述理由及相應(yīng)的科學依據(jù)����,并依據(jù)產(chǎn)品的具體特性對注冊申報資料的內(nèi)容進行充實和細化。
本指導原則是供注冊申請人和技術(shù)審評人員使用的指導性文件�����,但不包括審評審批所涉及的行政事項���,亦不作為法規(guī)強制執(zhí)行�,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本指導原則����。如果有能夠滿足相關(guān)法規(guī)要求的其他方法,也可以采用���,但是需要提供詳細的研究資料和驗證資料��。
本指導原則是在現(xiàn)行法規(guī)和標準體系以及當前認知水平下制定��,隨著法規(guī)和標準的不斷完善����,以及科學技術(shù)的不斷發(fā)展,相關(guān)內(nèi)容也將適時進行調(diào)整���。
一��、適用范圍
本指導原則適用于中醫(yī)脈診設(shè)備���。根據(jù)《醫(yī)療器械分類目錄》,申報產(chǎn)品的管理分類為Ⅱ類���,管理代號為20中醫(yī)器械-01中醫(yī)診斷設(shè)備-01脈診設(shè)備���,指通常由主機、加壓裝置和壓力傳感器組成�。經(jīng)壓力傳感器通過皮表對橈動脈及周邊組織的腕部寸、關(guān)�、尺部位以無創(chuàng)的方式,在施加外力的條件下進行脈圖采集的設(shè)備��。本指導原則同樣適用于中醫(yī)臨床用于采集、存儲脈象數(shù)據(jù)�,計算脈象參數(shù)特征信息的設(shè)備。其他包含中醫(yī)脈圖數(shù)據(jù)采集���、存儲與參數(shù)計算功能的組合式醫(yī)療器械的相關(guān)部分可參考本指導原則的適用部分�。
二��、注冊審查要點
(一)監(jiān)管信息
注冊申請人(以下簡稱申請人)需要描述申報產(chǎn)品的管理類別���、分類編碼、產(chǎn)品名稱的確定依據(jù)��。
1.產(chǎn)品名稱
產(chǎn)品的命名應(yīng)符合《醫(yī)療器械通用名稱命名規(guī)則》和國家標準�����、行業(yè)標準上的通用名稱要求��。參照《醫(yī)療器械通用名稱命名指導原則》確定產(chǎn)品名稱����,產(chǎn)品名稱由一個核心詞和不超過三個的特征詞組成,如“脈象診測信息采集系統(tǒng)”�����、“中醫(yī)脈象診斷系統(tǒng)”、“脈診儀”�、“脈象儀”。若產(chǎn)品具有其他性能特征����,如加壓壓力與采集位置可調(diào)、數(shù)據(jù)存儲傳輸?shù)刃阅芸审w現(xiàn)在產(chǎn)品技術(shù)要求中���,不必體現(xiàn)在產(chǎn)品名稱中����。
2.分類編碼
根據(jù)《醫(yī)療器械分類目錄》�����,分類編碼為20-01-01��,管理類別為Ⅱ類�。
3.注冊單元劃分的原則和實例
注冊單元劃分應(yīng)符合《醫(yī)療器械注冊單元劃分指導原則》的要求,原則上以申報產(chǎn)品的技術(shù)原理��、結(jié)構(gòu)組成和適用范圍為劃分依據(jù)���。性能差異較大�、核心功能的實現(xiàn)原理差異較大、結(jié)構(gòu)組成差異較大的應(yīng)考慮劃分為不同的注冊單元�。
例如:按照產(chǎn)品的工作方式區(qū)分為臺車/便攜/可穿戴式需劃分為不同的注冊單元。按照主機類型是硬件控制型/軟件控制型需劃分為不同的注冊單元���。按照產(chǎn)品的加壓方式區(qū)分為氣動加壓/電機加壓/手動加壓需劃分為不同的注冊單元�。按照脈圖數(shù)據(jù)采集傳感器的工作原理不同需劃分為不同的注冊單元���。按照產(chǎn)品的預期用途不同需劃分為不同的注冊單元。
(二)綜述資料
1.概述
申請人需描述中醫(yī)脈診設(shè)備的通用名稱及確定依據(jù)�����、產(chǎn)品適用范圍�。如適用,申請人應(yīng)提供設(shè)備的背景信息概述�����。
2.產(chǎn)品描述
2.1設(shè)備的結(jié)構(gòu)組成
中醫(yī)脈診設(shè)備包含壓力傳感器�、加壓裝置、數(shù)據(jù)采集部件�����。不同類型的脈診產(chǎn)品可能包含:電腦主機、軟件���、顯示設(shè)備�����,以及其他為實現(xiàn)中醫(yī)脈象數(shù)據(jù)采集����、存儲�����、計算功能而配合使用的模塊或部件���。
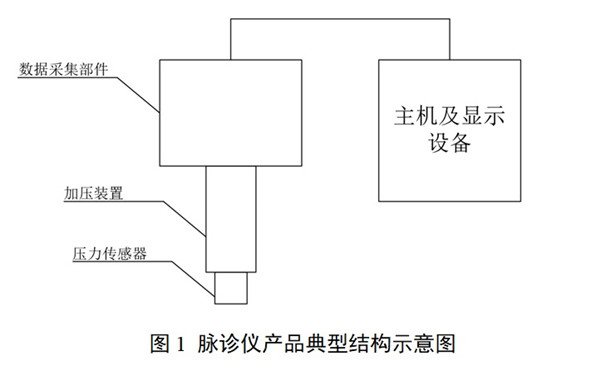
申請人應(yīng)對產(chǎn)品構(gòu)造進行描述����,包括主要結(jié)構(gòu)組成和關(guān)鍵部件�����,并給出各個模塊的詳細文字或者圖片的說明與標識。
2.2工作原理
中醫(yī)脈診設(shè)備通過加壓裝置將壓力傳感器壓至腕部橈動脈寸�、關(guān)、尺部位��,并施加不同的壓力��,通過數(shù)據(jù)采集部件采集脈象數(shù)據(jù)�。通過其他配合使用的模塊實現(xiàn)對中醫(yī)脈象數(shù)據(jù)的采集、存儲����、計算等功能。
按照同時采集脈搏信號的個數(shù)分為單點���、三點、多點傳感器��。
按照操作方式分為自動加壓和手動加壓�����,手動加壓為操作者采用手動的方式操作加壓裝置��,實現(xiàn)申報產(chǎn)品施加在橈動脈采集位置的壓力變化���。自動加壓為申報產(chǎn)品可以通過電子裝置實現(xiàn)施加在橈動脈采集位置的壓力變化����。
根據(jù)加壓裝置的工作原理,自動加壓一般分為氣動加壓和電機加壓兩種方式��。氣動加壓裝置通過可調(diào)節(jié)內(nèi)部壓力的氣囊與傳感器連接���,通過改變氣囊內(nèi)壓強來推動壓力傳感器���,實現(xiàn)不同壓力下采集脈圖數(shù)據(jù)。電機加壓裝置通過電機推動壓力傳感器實現(xiàn)不同壓力下采集脈圖數(shù)據(jù)�。
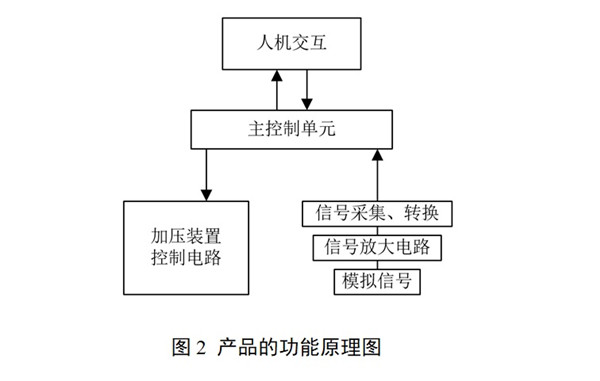
申請人應(yīng)根據(jù)申報產(chǎn)品特點明確加壓裝置的工作原理、加壓裝置與壓力傳感器的連接方式�����。如申報產(chǎn)品預期用途包含對脈圖數(shù)據(jù)的計算和存儲功能��,需明確申報產(chǎn)品工作時所依據(jù)的脈診理論來源����,列出具有說服力的中醫(yī)診斷教材或者已發(fā)表的論文著作。對于實現(xiàn)預期用途的方法以及數(shù)據(jù)存儲的情況進行描述����,并說明采用該方法的原因和理論基礎(chǔ)����。產(chǎn)品功能原理見圖2���。
2.3型號規(guī)格
申請人需要詳細說明申報產(chǎn)品的型號規(guī)格�,如申報產(chǎn)品存在多個型號規(guī)格或配置�,需要詳細說明各個型號規(guī)格、配置之間的差異���,包括:結(jié)構(gòu)組成����、技術(shù)特征��、性能指標�、工作方式��、適用范圍�、使用環(huán)境等內(nèi)容。申請人需要以對比表格的形式��,附帶詳細的文字和圖片解釋不同型號規(guī)格之間的差異。
2.4包裝說明
申請人應(yīng)詳細描述申報產(chǎn)品中注冊單元所有產(chǎn)品組成的包裝情況��,說明包裝清單和包裝方式�,提供包裝圖示。
2.5研發(fā)歷程
如適用��,應(yīng)描述申報產(chǎn)品的研發(fā)背景和目的�����,如申報產(chǎn)品的研發(fā)歷史概述����、歷次注冊申請?zhí)峤坏男畔ⅰ4送?��,還應(yīng)在研發(fā)背景中描述產(chǎn)品改進的內(nèi)容���、實現(xiàn)方式、解決的技術(shù)問題或臨床問題等�。
2.6與同類和/或前代產(chǎn)品的參考和比較
對于研發(fā)參考的同類產(chǎn)品或前代產(chǎn)品,應(yīng)說明選擇其作為研發(fā)參考的原因����。同時列表說明申報產(chǎn)品與研發(fā)參考產(chǎn)品在工作原理��、結(jié)構(gòu)組成�����、性能指標及適用范圍等方面的異同��。
區(qū)別于其他同類產(chǎn)品的特征是技術(shù)審評的關(guān)注點��,如設(shè)備適用范圍�、結(jié)構(gòu)組成�����、性能指標等���。
3.適用范圍和禁忌證
3.1適用范圍
申請人應(yīng)依據(jù)臨床評價資料并結(jié)合相關(guān)臨床診療規(guī)范來明確申報產(chǎn)品的適用范圍�����。
中醫(yī)脈診設(shè)備的預期用途應(yīng)體現(xiàn)其臨床應(yīng)用范圍���。應(yīng)與醫(yī)療器械注冊申請表、綜述資料���、臨床評價資料���、產(chǎn)品風險分析資料、產(chǎn)品說明書等方面闡述保持一致����。例如:用于中醫(yī)脈診。
3.2預期使用環(huán)境
申請人應(yīng)詳細描述申報產(chǎn)品的使用環(huán)境和產(chǎn)品保存環(huán)境要求���。包括:產(chǎn)品的貯存��、運輸和使用環(huán)境的溫度�、濕度等要求�����。
3.3適用人群與禁忌證
申請人應(yīng)說明申報產(chǎn)品適用人群的標準����。中醫(yī)脈診設(shè)備一般不適用于以下人群:
(1)腕關(guān)節(jié)損傷、腕部皮膚過敏或破損者����;
(2)橈動脈搏動消失(無脈癥)患者�,橈動脈解剖位置異常(斜飛脈或反關(guān)脈)患者����;
(3)肢體震顫,如帕金森患者���;
4.申報產(chǎn)品上市歷史
如適用�,申請人需提供以下相關(guān)資料:
4.1上市情況���。申報產(chǎn)品在各國家或地區(qū)的上市批準時間����、銷售情況��。
4.2不良事件和召回�。
4.3銷售、不良事件及召回率��。
5.其他需說明的內(nèi)容
若適用���,申請人可以提供申報產(chǎn)品需要重點關(guān)注的其他內(nèi)容和支持性資料����。
(三)非臨床資料
1. 產(chǎn)品風險管理資料
應(yīng)符合GB/T 42062《醫(yī)療器械風險管理對醫(yī)療器械的應(yīng)用》的有關(guān)要求。
2. 醫(yī)療器械安全和性能基本原則清單
申請人應(yīng)提供《醫(yī)療器械安全和性能基本原則清單》����,并說明申請產(chǎn)品為了符合適用的各項要求所采用的方法�����,并提供相關(guān)文件�。
3. 產(chǎn)品技術(shù)要求及檢驗報告
3.1申報產(chǎn)品適用標準情況
注冊申請人需列表說明申報產(chǎn)品執(zhí)行和參考的國家標準和行業(yè)標準。
中醫(yī)脈診設(shè)備適用的標準為:YY/T 1489《中醫(yī)脈圖采集設(shè)備》�,電氣安全應(yīng)符合GB 9706.1的要求,電磁兼容應(yīng)符合YY 9706.102的要求�。
3.2產(chǎn)品技術(shù)要求
注冊申請人應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導原則》編寫產(chǎn)品技術(shù)要求,結(jié)合申報產(chǎn)品的特點設(shè)置條款����。
產(chǎn)品技術(shù)要求明確產(chǎn)品規(guī)格型號及劃分說明。要注明軟件發(fā)布版本�����、軟件版本命名規(guī)則����,其中軟件版本命名規(guī)則需與質(zhì)量管理體系保持一致��。
產(chǎn)品技術(shù)指標可參考YY/T 1489《中醫(yī)脈圖采集設(shè)備 》����。
(1)工作條件�����。
(2)外加力學量施加裝置的安全限值���。
(3)外加力學量的準確性��。
(4)脈壓準確性��。
(5)脈率準確性�����。
(6)泄壓功能����。
(7)傳感器有效幾何尺寸�。
(8)動態(tài)放大器的時間常數(shù)��。
(9)工作噪聲��。
(10)外觀���。
除參考行業(yè)標準YY/T 1489的要求外,軟件功能及網(wǎng)絡(luò)安全應(yīng)根據(jù)產(chǎn)品的實際情況編寫���。電氣安全應(yīng)符合GB 9706.1的要求;電磁兼容應(yīng)符合YY9706.102的要求���。
3.3檢驗報告
注冊申請人應(yīng)提供產(chǎn)品檢驗報告�,產(chǎn)品檢驗報告應(yīng)符合國務(wù)院藥品監(jiān)督管理部門的要求���,可以是醫(yī)療器械注冊申請人的自檢報告���,也可以是委托具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的檢驗報告。
檢驗報告提供軟件版本界面照片或列明軟件版本信息��,有用戶界面的軟件體現(xiàn)軟件發(fā)布版本��、軟件完整版本�,無用戶界面的軟件體現(xiàn)軟件完整版本���。
同一注冊單元內(nèi)注冊檢驗代表產(chǎn)品確定原則和實例。
用于檢驗產(chǎn)品應(yīng)當能夠代表申請注冊產(chǎn)品的安全性和有效性�,應(yīng)充分考慮產(chǎn)品功能、結(jié)構(gòu)組成����、控制方式及其他風險等方面;代表產(chǎn)品應(yīng)是功能�、配置最齊全、結(jié)構(gòu)最復雜���、風險最高的產(chǎn)品�����。
注冊單元內(nèi)各型號的主要安全指標��、性能指標不能被代表型號全部涵蓋時�,則應(yīng)選擇涵蓋安全指標����、性能指標最多的產(chǎn)品作為代表產(chǎn)品,還應(yīng)考慮其他型號中未被代表型號所涵蓋的安全指標及性能指標。
與性能和安全項目關(guān)注點不同���,電磁兼容方面的典型性產(chǎn)品應(yīng)充分考慮注冊單元內(nèi)不同型號之間電磁兼容特點和差異��。
4. 研究資料
除根據(jù)申報產(chǎn)品適用范圍和技術(shù)特征提供非臨床研究綜述外�����,還應(yīng)針對中醫(yī)脈診設(shè)備產(chǎn)品的具體特點���,提供產(chǎn)品使用準確性的研究資料,如:數(shù)據(jù)采集準確性研究����、數(shù)據(jù)分析準確性研究等��。
4.1生物相容性研究
依據(jù) GB /T 16886.1標準要求開展生物學評價��。按照患者和使用者直接接觸具體部件進行相應(yīng)的評價�。設(shè)備一般與人體皮膚接觸的部件有傳感器、加壓裝置��、輔助采集模塊��。例如��,傳感器與腕部皮膚短期接觸,按照GB /T 16886.1標準的要求���,生物相容性評價至少應(yīng)考慮以下方面的要求:細胞毒性�����、致敏���、皮膚刺激。對不同接觸類型的部件應(yīng)分別進行評價�����?��;砻膺M行試驗的項目宜給出充分理由和論證�����。
4.2軟件研究
產(chǎn)品結(jié)構(gòu)組成中若包含作為醫(yī)療器械組成部分的軟件�����,應(yīng)參照《醫(yī)療器械軟件注冊審查指導原則(2022年修訂版)》的要求提供研究資料�����,內(nèi)容包括基本信息�����、實現(xiàn)過程��、核心功能��、結(jié)論等內(nèi)容����,詳盡程度取決于軟件安全性級別,該類產(chǎn)品一般為中等�。其中��,基本信息包括軟件標識���、安全性級別�、結(jié)構(gòu)功能��、物理拓撲、運行環(huán)境�、注冊歷史,實現(xiàn)過程包括開發(fā)概況���、風險管理���、需求規(guī)范、生存周期�、驗證與確認、可追溯性分析���、缺陷管理�����、更新歷史���,明確核心功能、核心算法���、預期用途的對應(yīng)關(guān)系���。軟件功能的驗證與確認至少應(yīng)體現(xiàn)適用范圍中宣稱的測量功能���,且應(yīng)當與其它申報資料保持一致。
產(chǎn)品若具備電子數(shù)據(jù)交換�����、遠程控制或用戶訪問功能的獨立軟件和含有軟件組件的產(chǎn)品����,應(yīng)當參照《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導原則(2022年修訂版)》提供研究資料,基本信息包括軟件信息��、數(shù)據(jù)架構(gòu)���、網(wǎng)絡(luò)安全能力�、網(wǎng)絡(luò)安全補丁�、安全軟件,實現(xiàn)過程包括風險管理�����、需求規(guī)范����、驗證與確認、可追溯性分析�、更新維護計劃,漏洞評估明確已知漏洞相關(guān)信息���。應(yīng)提交網(wǎng)絡(luò)安全描述文檔�����,并在產(chǎn)品技術(shù)要求中規(guī)定相應(yīng)的性能指標�����。
通過電子接口與其他醫(yī)療器械或非醫(yī)療器械交換并使用信息���,應(yīng)提供互操作性研究資料,包括基本信息�����、需求規(guī)范��、風險管理��、驗證與確認�、維護計劃等內(nèi)容��。
4.3清潔消毒研究
申請人應(yīng)開展清潔消毒研究����。申報產(chǎn)品在使用前應(yīng)對與患者接觸部件進行清潔消毒處理���。應(yīng)當明確推薦的清洗和消毒工藝(方法和參數(shù))���、工藝的確定依據(jù)以及驗證的相關(guān)研究資料。
5. 穩(wěn)定性研究
使用期限一般主要取決于使用過程中部件�、元器件的損耗、老化等���,注冊申請人應(yīng)按照聲稱的使用期限對設(shè)備進行老化/疲勞試驗�,也可對影響設(shè)備使用期限的關(guān)鍵部件進行老化/疲勞試驗�,例如設(shè)備中不可更換(或更換成本高)的部件,并提供相應(yīng)的研究資料��。研究資料應(yīng)能證明上述部件按照所聲稱的使用期限�����,經(jīng)過老化/疲勞試驗后�,產(chǎn)品性能和安全仍符合預期的要求。使用期限也可基于已有數(shù)據(jù)進行合理的推斷���、分析�、計算得出��,但應(yīng)提供詳細的說明及支持性資料�。可參考《有源醫(yī)療器械使用期限技術(shù)審查指導原則》的要求��。
注冊申請人對包裝和產(chǎn)品進行模擬試驗�,模擬在貯存和運輸過程中,遇到極端情況時�����,例如環(huán)境(溫濕度�、氣壓等)變化、跌落����、振動、加速度等�����,產(chǎn)品不會發(fā)生性能、功能改變����,包裝系統(tǒng)具有保護產(chǎn)品的能力。經(jīng)過模擬試驗后��,觀察包裝外觀是否有不可接受的異?���,F(xiàn)象,對產(chǎn)品進行性能測試���,證明運輸和環(huán)境測試后產(chǎn)品能夠保持其完整性和功能性�。環(huán)境試驗可參考GB/T14710的要求����。
(四)臨床評價資料
中醫(yī)脈診設(shè)備的臨床評價應(yīng)遵循該類產(chǎn)品研發(fā)的基本規(guī)律以及中醫(yī)理論和實踐,通過科學的過程來評估產(chǎn)品臨床療效和潛在風險�,最終確定產(chǎn)品在預期用途下的安全性和有效性,并為產(chǎn)品使用說明書的撰寫提供依據(jù)����。
申請人可參考《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》《醫(yī)療器械臨床評價技術(shù)指導原則》《醫(yī)療器械等同性論證技術(shù)指導原則》《決策是否開展醫(yī)療器械臨床試驗技術(shù)指導原則》等相關(guān)要求開展中醫(yī)脈診設(shè)備的臨床評價并提供臨床評價資料。
臨床評價資料應(yīng)包含:
1.產(chǎn)品描述和研發(fā)背景:包括申報產(chǎn)品基本信息、適用范圍�����、現(xiàn)有的診斷或治療方法及涉及醫(yī)療器械的臨床應(yīng)用情況�����、申報產(chǎn)品與現(xiàn)有診斷或治療方法的關(guān)系��、預期達到的臨床療效等�����。
2.明確臨床評價涵蓋的范圍��,申報產(chǎn)品中如有可免于進行臨床評價的部分��,描述其結(jié)構(gòu)組成并說明免于進行臨床評價的理由��。
3.臨床評價路徑:根據(jù)申報產(chǎn)品的適用范圍���、技術(shù)特征、已有臨床數(shù)據(jù)等具體情況�����,選擇恰當?shù)呐R床評價路徑,包括同品種臨床評價路徑和/或臨床試驗路徑����。
4.若通過同品種臨床評價路徑進行臨床評價,應(yīng)當提交申報產(chǎn)品與同品種醫(yī)療器械在適用范圍�����、技術(shù)特征�、生物學特性方面的對比資料;應(yīng)當對同品種醫(yī)療器械的臨床數(shù)據(jù)進行收集�、評估和分析,形成臨床證據(jù)�����。如適用��,應(yīng)當描述申報產(chǎn)品與同品種醫(yī)療器械的差異�����,提交充分的科學證據(jù)證明二者具有相同的安全有效性��。
5.若通過臨床試驗路徑進行臨床評價,應(yīng)當提交臨床試驗方案��、臨床試驗機構(gòu)倫理委員會同意開展臨床試驗的書面意見���、臨床試驗報告�、知情同意書樣本�����,并附臨床試驗數(shù)據(jù)庫(原始數(shù)據(jù)庫����、分析數(shù)據(jù)庫�、說明性文件和程序代碼)。
建議申請人結(jié)合中醫(yī)脈診設(shè)備的風險和受益����,選擇合理的臨床評價路徑,論證其臨床應(yīng)用的安全有效性���。
(五)產(chǎn)品說明書和標簽樣稿
申報產(chǎn)品的說明書�、標簽樣稿應(yīng)當符合《醫(yī)療器械說明書和標簽管理規(guī)定》以及GB 9706.1���、YY 9706.102中有關(guān)要求��,除此之外�,說明書中還應(yīng)包含以下內(nèi)容:
1.明確申報設(shè)備的消毒方式。
2.明確申報設(shè)備的有效期����。
3.應(yīng)說明申報設(shè)備的安裝、拆卸����、更換方式。
4.使用說明任何意外情況時����,操作者快速安全地從患者身上移除脈象采集設(shè)備的加壓裝置的操作步驟及方法。
產(chǎn)品說明書的內(nèi)容均應(yīng)有明確的來源�,與綜述資料、研究資料及產(chǎn)品技術(shù)要求等注冊申報資料的內(nèi)容保持一致���。說明書中涉及技術(shù)內(nèi)容且產(chǎn)品技術(shù)要求中未包含的��,應(yīng)提交相應(yīng)驗證資料����。
產(chǎn)品說明書還需結(jié)合產(chǎn)品特點明確以下內(nèi)容:
(1)設(shè)備的注意事項及警告信息。
(2)明確“本產(chǎn)品須在醫(yī)療機構(gòu)中使用�,在使用前請務(wù)必詳細閱讀使用說明書”。
(3)設(shè)備電磁兼容的相關(guān)信息���。應(yīng)給出設(shè)備電磁兼容信息的相關(guān)說明及工作環(huán)境���。
(六)質(zhì)量管理體系文件
產(chǎn)品的質(zhì)量管理體系文件應(yīng)符合《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的要求,并按《醫(yī)療器械注冊申報資料要求及說明》提交資料����。
應(yīng)明確產(chǎn)品生產(chǎn)工藝過程,可采用流程圖的形式���,并說明其過程控制點,且應(yīng)結(jié)合產(chǎn)品實際生產(chǎn)過程細化產(chǎn)品生產(chǎn)工藝介紹����,應(yīng)能體現(xiàn)出外協(xié)加工部分(如有)、半成品加工過程��,工藝流程圖中應(yīng)明示關(guān)鍵工序����、特殊過程(如有)�����、過程控制點�、各生產(chǎn)檢驗工序?qū)Νh(huán)境的要求���、使用的相關(guān)設(shè)備及對設(shè)備精度的要求等相關(guān)信息�。
應(yīng)詳細介紹研制場地���、生產(chǎn)場地情況���,并應(yīng)結(jié)合前面介紹的產(chǎn)品加工工藝,以及工序和工位的劃分��、預計產(chǎn)量�����、生產(chǎn)線劃分等實際需求細化研發(fā)���、生產(chǎn)�����、檢驗���、庫房場地面積��、環(huán)境控制等相關(guān)情況說明����。
若產(chǎn)品有多個研制��、生產(chǎn)場地���,應(yīng)概述每個研制���、生產(chǎn)場地的實際情況。
如有中醫(yī)脈診儀注冊服務(wù)需求�,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)���,聯(lián)系人:葉工����,電話:18058734169�,微信同����。