口罩出口歐盟對于貿易商來說主要是辦理二類醫(yī)療器械經營備案憑證(針對醫(yī)用口罩)���,對于制造商來說���,要求就復雜的多。本文總結性的為您講述口罩出口歐盟的法規(guī)要求�。
引言:口罩出口歐盟對于貿易商來說主要是辦理二類醫(yī)療器械經營備案憑證(針對醫(yī)用口罩),對于制造商來說�,要求就復雜的多。本文總結性的為您講述口罩出口歐盟的法規(guī)要求����。

口罩出口歐盟的法規(guī)要求:
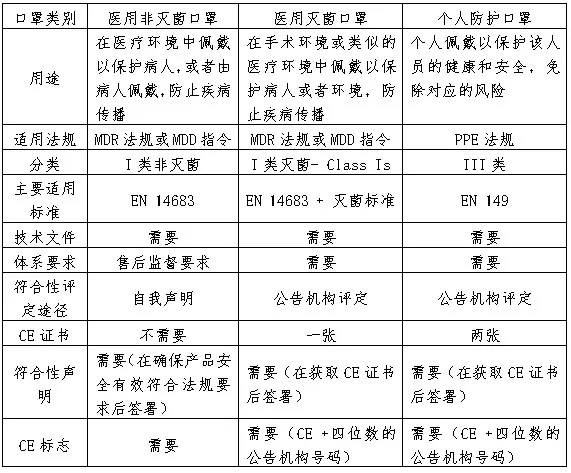
按照MDD或者MDR的要求�,醫(yī)用非滅菌口罩可以由制造商采取自我聲明方式,加貼CE標志后上市銷售���。而醫(yī)用滅菌口罩必須經公告機構符合性評定�����,才能加貼CE標志上市銷售����。但不管是否需要公告機構符合性評定,制造商都需要按照法規(guī)要求�,參照相關標準或者滿足歐盟質量要求的標準進行測試,以證實產品安全有效����,并建立技術文件和質量管理體系,保證產品的質量安全和持續(xù)有效�����。 參照MDR法規(guī)附錄II和附錄III的要求(MDD為附錄7)�����,技術文件通常包括以下七個部分: 器械的描述和規(guī)范�����,包括名稱����、預期用途�、分類�����、原料����、構成����、技術規(guī)范等。 產品的驗證和確認,包括臨床前的測試和臨床(評估)數(shù)據(jù) 質量管理體系可以參照協(xié)調性標準ISO 13485:2016進行�。需要說明的是:質量管理體系需要參照ISO13485:2016來運行或者審核,但對于公告機構符合性評定來說�,ISO13485認證證書并不是必須或者強制的,但多數(shù)的制造商都會選擇取得ISO 13485認證證書���,這樣可以提高客戶對制造商能滿足法規(guī)要求及產品質量保證的信心���。 對于歐盟境外的制造商(如中國的制造商)�,需要在歐盟境內授權一個歐盟代表��,代替制造商在歐盟進行相關活動�����,比如在主管當局進行自我聲明產品的登記和不良事件的報告等����。制造商需要和授權歐盟代表簽訂協(xié)議,并規(guī)定各自承擔的職責����。按照新的MDR法規(guī),制造商需要將整套的技術文件提交給歐盟代表��,以便主管當局備查��。 按照PPE法規(guī)要求����,個人防護口罩需要有公告機構審核發(fā)放的CE證書,才能在歐盟合法上市銷售。根據(jù)PPE法規(guī)關于符合性的相關規(guī)定�����,制造商需要建立相應技術文件�����,并滿足EN149:2001+A1:2009的規(guī)格和測試要求����。和醫(yī)用口罩相比,個人防護口罩至少需獲得兩張公告機構的證書�,即按照附錄五的型式檢驗證書,按照附錄七(Module C2)的證書或者附錄八(Module D)的證書�,詳見下圖:

下表為您整理了醫(yī)用口罩和個人防護口罩出口歐盟的流程異同:
標簽:二類醫(yī)療器械經營備案���、醫(yī)療器械備案