昨日(2022年6月30日)���,國家藥監(jiān)局發(fā)布《支持港澳醫(yī)療器械注冊人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實施方案》藥監(jiān)綜藥注〔2022〕61號�,文件可稱為“港澳醫(yī)療器械注冊人跨境委托生產(chǎn)實施方案”�����,方案的出臺�,對原有港澳進口醫(yī)療器械注冊路徑是一個大的變化,也為境外醫(yī)療器械進入內(nèi)地市場提供了一條新路��。
昨日(2022年6月30日),國家藥監(jiān)局發(fā)布《支持港澳醫(yī)療器械注冊人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實施方案》藥監(jiān)綜藥注〔2022〕61號�,文件可稱為“港澳醫(yī)療器械注冊人跨境委托生產(chǎn)實施方案”,方案的出臺��,對原有港澳進口醫(yī)療器械注冊路徑是一個大的變化�,也為境外醫(yī)療器械進入內(nèi)地市場提供了一條新路。
支持港澳醫(yī)療器械注冊人在大灣區(qū)內(nèi)地9市生產(chǎn)醫(yī)療器械實施方案
為貫徹落實《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》中“在粵港澳大灣區(qū)開展醫(yī)療器械注冊人制度改革”有關(guān)要求����,支持港澳醫(yī)療器械注冊人將持有的醫(yī)療器械在粵港澳大灣區(qū)內(nèi)地9市符合條件的企業(yè)生產(chǎn)(以下簡稱“港澳醫(yī)療器械注冊人 跨境委托生產(chǎn)”)。經(jīng)研究�,制定工作方案如下:
一、工作目標
以習近平新時代中國特色社會主義思想為指導��,深入貫徹落實習近平總書記關(guān)于粵港澳大灣區(qū)建設(shè)的重要指示精神和要求����,按照黨中央����、國務(wù)院決策部署和市場監(jiān)管總局等8部門印發(fā)《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》有關(guān)規(guī)定,深化醫(yī)療器械注冊人改革�,允許港澳醫(yī)療器械注冊人跨境委托生產(chǎn),進一步推動粵港澳大灣區(qū)生物醫(yī)藥產(chǎn)業(yè)深度融合���,實現(xiàn)粵港澳大灣區(qū)醫(yī)藥產(chǎn)業(yè)共同發(fā)展�����。
二���、職責分工
國家藥監(jiān)局負責對港澳醫(yī)療器械注冊證變更實施審批��。
廣東省藥監(jiān)局負責港澳醫(yī)療器械注冊人跨境委托生產(chǎn)涉及的醫(yī)療器械生產(chǎn)許可工作���,以及組織開展醫(yī)療器械注冊質(zhì)量管理體系核查,并落實屬地監(jiān)管責任��,加強對轄區(qū)內(nèi)相關(guān)企業(yè)的監(jiān)督檢查�����。
三��、適用范圍
(一)品種范圍:適用于在香港特別行政區(qū)或澳門特別行政區(qū)合法登記的企業(yè)所持有和生產(chǎn)�����,并已獲得《醫(yī)療器械注冊證》在境內(nèi)注冊上市的醫(yī)療器械���?��!督刮猩a(chǎn)醫(yī)療器械目錄》(國家藥監(jiān)局通告2022年第17號)規(guī)定的品種除外���。
(二)適用企業(yè):醫(yī)療器械注冊人為港澳企業(yè)的,由其在大灣區(qū)內(nèi)地設(shè)立的外商投資企業(yè)法人作為代理人�����,辦理醫(yī)療器械變更注冊事項�,協(xié)助港澳醫(yī)療器械注冊人履行義務(wù),承擔連帶責任����。
港澳醫(yī)療器械注冊人獲得國家藥監(jiān)局發(fā)放的醫(yī)療器械注冊證后,可以委托大灣區(qū)內(nèi)地9市符合條件的企業(yè)生產(chǎn)�。受托生產(chǎn)企業(yè)應(yīng)當具備與所生產(chǎn)醫(yī)療器械相適應(yīng)的質(zhì)量管理體系和生產(chǎn)能力。
四�、工作程序
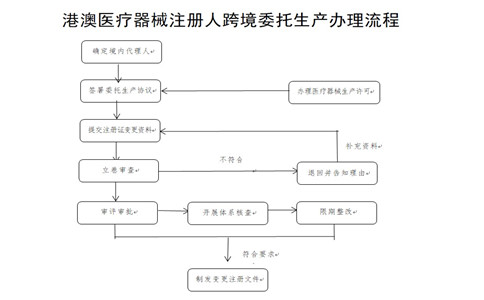
(一)確定境內(nèi)代理人�����。港澳醫(yī)療器械注冊人由其在大灣區(qū)內(nèi)地設(shè)立的外商投資企業(yè)法人作為代理人�����,辦理醫(yī)療器械變更注冊事項,協(xié)助港澳醫(yī)療器械注冊人履行《醫(yī)療器械監(jiān)督管理條例》第二十條義務(wù)����,承擔連帶責任。該代理人應(yīng)與港澳醫(yī)療器械注冊人所持有醫(yī)療器械注冊證登載的代理人一致��。
(二)簽署委托生產(chǎn)協(xié)議���。港澳醫(yī)療器械注冊人在粵港澳大灣區(qū)內(nèi)地9市選擇符合條件的企業(yè)作為受托生產(chǎn)企業(yè)�,參考國家藥監(jiān)局制定的醫(yī)療器械委托生產(chǎn)質(zhì)量協(xié)議指南要求����,由港澳醫(yī)療器械注冊人、代理人和受托生產(chǎn)企業(yè)三方共同簽訂質(zhì)量協(xié)議以及委托協(xié)議�����,監(jiān)督受托生產(chǎn)企業(yè)履行有關(guān)協(xié)議約定的義務(wù)��。
(三)變更醫(yī)療器械注冊證生產(chǎn)地址����。代理人協(xié)助港澳醫(yī)療器械注冊人向國家藥監(jiān)局提交符合要求的申請材料��。國家藥監(jiān)局器審中心按照程序開展審評審批工作�。廣東省藥監(jiān)局按照醫(yī)療器械注冊質(zhì)量體系核查有關(guān)要求��、生產(chǎn)質(zhì)量管理規(guī)范及其附錄的要求組織開展現(xiàn)場體系核查���。經(jīng)技術(shù)審評及注冊質(zhì)量體系核查�,符合要求的��,準予變更注冊�����,發(fā)放《醫(yī)療器械變更注冊文件》����,載明受托生產(chǎn)企業(yè)名稱、生產(chǎn)地址及原注冊證號等信息����。
(四)受托生產(chǎn)企業(yè)履行報告義務(wù)。港澳醫(yī)療器械注冊人完成醫(yī)療器械注冊證變更后�,受托生產(chǎn)企業(yè)應(yīng)當向廣東省藥監(jiān)局報告增加生產(chǎn)產(chǎn)品品種���,并提供委托方�、受托生產(chǎn)產(chǎn)品、受托期限等信息����。
五、申報資料
按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(國家藥監(jiān)局公告2021年第121號)和《關(guān)于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(國家藥監(jiān)局公告2021年第122號)有關(guān)要求提交變更注冊申報資料�。
六、實施依據(jù)
《醫(yī)療器械監(jiān)督管理條例》《醫(yī)療器械注冊與備案管理辦法》《體外診斷試劑注冊與備案管理辦法》《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》《粵港澳大灣區(qū)藥品醫(yī)療器械監(jiān)管創(chuàng)新發(fā)展工作方案》等�����。
七�����、注冊收費
醫(yī)療器械注冊收費標準按照《國家食品藥品監(jiān)督管理總局關(guān)于發(fā)布藥品����、醫(yī)療器械產(chǎn)品注冊收費標準的公告》(2015年53號)要求執(zhí)行。
八��、工作要求
(一)港澳醫(yī)療器械注冊人跨境委托生產(chǎn)的醫(yī)療器械��,原則上應(yīng)當與醫(yī)療器械注冊證及其附件載明的相關(guān)事項保持一致��,其主要原材料和生產(chǎn)工藝不應(yīng)發(fā)生改變,產(chǎn)品在境內(nèi)生產(chǎn)的質(zhì)量管理體系應(yīng)當與境外生產(chǎn)質(zhì)量管理體系具有等同性���。
(二)港澳醫(yī)療器械注冊人應(yīng)當嚴格落實醫(yī)療器械全生命周期質(zhì)量管理主體責任�,按照《醫(yī)療器械監(jiān)督管理條例》《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》等要求����,建立健全質(zhì)量管理體系并保證有效運行,切實履行全過程質(zhì)量管理����、不良事件監(jiān)測及產(chǎn)品召回等義務(wù)。
(三)港澳醫(yī)療器械注冊人在大灣區(qū)內(nèi)地9市的生產(chǎn)經(jīng)營行為違反《醫(yī)療器械監(jiān)督管理條例》及配套規(guī)章制度的�,注冊人承擔主體責任,代理人承擔連帶責任�,受托生產(chǎn)企業(yè)承擔相應(yīng)法律責任。港澳醫(yī)療器械注冊人��、代理人應(yīng)當每年對質(zhì)量管理體系的運行情況進行自查�����,并于次年3月31日前通過省藥監(jiān)局網(wǎng)上平臺提交自查報告���。
(四)廣東省藥監(jiān)局按照“問題導向����,防范風險����,責任明晰”的原則,創(chuàng)新醫(yī)療器械監(jiān)管方式�����,與港澳監(jiān)管部門探索建立信息暢通��、銜接有序�、協(xié)作有力的監(jiān)管工作機制,完善事中事后監(jiān)管體系�����,增強監(jiān)管合力�����。夯實港澳注冊人醫(yī)療器械全生命周期質(zhì)量管理責任���,監(jiān)督代理人對研制�����、生產(chǎn)��、經(jīng)營���、使用全過程中醫(yī)療器械的安全性�����、有效性依法承擔連帶責任��,加強對受托生產(chǎn)企業(yè)相關(guān)生產(chǎn)活動的監(jiān)督檢查��,加強相關(guān)產(chǎn)品質(zhì)量抽檢和不良事件監(jiān)測工作����,提升分析預警能力����,切實防范醫(yī)療器械安全風險。
九�、其他事項
(一)港澳醫(yī)療器械注冊人可以在大灣區(qū)內(nèi)地9市符合條件的多家企業(yè)進行委托生產(chǎn)�����,辦理程序同上�����。
(二)港澳醫(yī)療器械注冊人解除跨境委托生產(chǎn)的,原受托生產(chǎn)企業(yè)應(yīng)當在30日內(nèi)向廣東省藥監(jiān)局報告�。
(三)關(guān)于港澳醫(yī)療器械注冊人委托生產(chǎn)的醫(yī)療器械上市銷售問題,由廣東省藥監(jiān)局牽頭與海關(guān)�、稅務(wù)、外匯管理等部門溝通��,協(xié)助企業(yè)實施依法合規(guī)的便捷跨境結(jié)算方式����。
標簽:港澳醫(yī)療器械注冊人跨境委托生產(chǎn)辦理流程