如何決策是否開展醫(yī)療器械臨床試驗��?除了看免于進行醫(yī)療器械臨床試驗目錄�����,查看同類產品上市情況之外�,總局發(fā)布的《決策是否開展醫(yī)療器械臨床試驗技術指導原則》同樣需要關注。
如何決策是否開展醫(yī)療器械臨床試驗�����?除了看免于進行醫(yī)療器械臨床試驗目錄,查看同類產品上市情況之外���,總局發(fā)布的《決策是否開展醫(yī)療器械臨床試驗技術指導原則》同樣需要關注�����。

決策是否開展醫(yī)療器械臨床試驗技術指導原則
決策是否開展醫(yī)療器械臨床試驗是綜合考慮產品的適用范圍��、技術特征�、生物學特性�����、風險程度及已有研究數據(包括臨床數據和非臨床數據)等方面來確定開展臨床試驗必要性的過程�����。需要開展臨床試驗的�,可根據具體情況,選擇在境內開展臨床試驗����、全部或同期在境外開展臨床試驗。
本指導原則旨在為注冊申請人和審查人員判斷擬申請注冊的產品是否需要開展臨床試驗提供技術指導,不涉及注冊審批等行政事項�����,亦不作為法規(guī)強制執(zhí)行����,如有能夠滿足法規(guī)要求的其他方法,也可以采用�����,但應提供詳細的研究資料和驗證資料�。應在遵循相關法規(guī)的前提下使用本指導原則�。
一、 適用范圍
本指導原則適用于需要開展臨床評價的第二類����、第三類醫(yī)療器械產品注冊時,是否需要開展臨床試驗的判定�,不適用于按醫(yī)療器械管理的體外診斷試劑。
二�、總則
在醫(yī)療器械設計開發(fā)過程中,設計確認是其重要環(huán)節(jié)����,以確保產品能夠滿足規(guī)定的使用要求或者預期用途的要求�??刹扇《喾N方法實現設計確認,如模體試驗�、計算機模擬試驗、動物試驗����、臨床評價等?��?捎糜谂R床評價的臨床數據包括在境內或境外�����,合法的臨床使用過程中生成的安全性��、有效性信息��,例如臨床試驗數據��、臨床文獻數據和臨床經驗數據等�����。鼓勵注冊申請人采用最有效的方式獲取證明符合醫(yī)療器械安全和性能基本原則所需的最少量信息����,消除或減輕不必要的負擔,可使患者能夠及早并持續(xù)獲得安全有效的醫(yī)療器械���。臨床試驗的必要性應全面考慮醫(yī)療器械的適用范圍��、技術特征��、生物學特性�、風險程度����、與現有醫(yī)療器械或現有診療方法的差異等方面��,如果非臨床研究的結果和/或現有臨床數據不足以證明產品對醫(yī)療器械安全和性能的基本原則的符合性����,則可能需要開展臨床試驗?�;诹己迷O計和規(guī)范實施的臨床試驗能夠提供科學��、可靠的醫(yī)療器械安全有效性數據。
本指導原則提到的符合醫(yī)療器械安全和性能基本原則���,是指對臨床證據與其他設計驗證和確認文件�����、器械描述���、說明書和標簽、風險管理文件以及生產信息進行綜合評價后得出的結論�����。
三��、考慮因素
(一) 臨床使用具有高風險的第三類醫(yī)療器械(以下簡稱“高風險醫(yī)療器械”)�����,原則上需要開展臨床試驗����,但以下情形可考慮免于開展臨床試驗:
1.申報產品的前代產品未在中國獲準上市,申報產品是對前代產品進行的設計變更��,注冊申請人可通過已有數據(如非臨床研究數據、前代產品的臨床試驗數據�����、申報產品境外臨床數據)證明申報產品符合醫(yī)療器械安全和性能基本原則����。
2.注冊申請人可按照《接受醫(yī)療器械境外臨床試驗數據技術指導原則》的要求提供申報產品境外臨床試驗數據,結合其他設計驗證和確認文件�����、器械描述�����、說明書和標簽���、風險管理文件以及生產信息進行綜合評價,證明申報產品符合醫(yī)療器械安全和性能的基本原則���。
3.申報產品的前代產品已在中國獲準上市�����,申報產品是對前代產品進行的設計變更�,且注冊申請人可通過已有數據(如非臨床研究數據、前代產品的臨床數據�、申報產品境外臨床數據)證明申報產品符合醫(yī)療器械安全和性能基本原則。
前代產品是指與申報產品屬于同一注冊申請人����、具有相同適用范圍且技術特征和生物學特性相似的產品,申報產品與前代產品為迭代關系����。
(二)申報產品雖然不屬于高風險醫(yī)療器械,但為新型醫(yī)療器械�����,原則上應開展臨床試驗���,但以下情形可考慮免于開展臨床試驗:
1.注冊申請人可通過非臨床研究數據充分證明申報產品符合醫(yī)療器械安全和性能基本原則�����。
2.申報產品在我國為新型醫(yī)療器械��,但其自身已有臨床數據(例如境外臨床文獻數據���、境外臨床試驗數據等)�,注冊申請人可通過非臨床研究數據���、申報產品的臨床數據證明申報產品符合醫(yī)療器械安全和性能基本原則�����。
3.申報產品在我國為新型醫(yī)療器械�����,但其前代產品已有境外臨床數據��,申報產品是對前代產品進行的設計變更���,注冊申請人可通過非臨床研究數據、申報產品的境外臨床數據和前代產品的境外臨床數據充分證明申報產品符合醫(yī)療器械安全和性能基本原則�����。
新型醫(yī)療器械是指與已在中國境內獲準上市的醫(yī)療器械相比�����,在適用范圍��、技術特征和/或生物學特性等方面具有顯著差異的醫(yī)療器械�����。大部分醫(yī)療器械是一個漸進的變更過程,并不屬于新型醫(yī)療器械�����,很多情形下���,可以通過非臨床研究來證明其符合醫(yī)療器械安全和性能的基本原則����。
(三)產品不屬于高風險醫(yī)療器械�,也不屬于新型醫(yī)療器械,在注冊申請人已開展充分的非臨床研究且全面收集已有臨床數據的基礎上����,若已有證據不能證明產品符合醫(yī)療器械安全和性能的基本原則時,有可能需要通過開展臨床試驗補充臨床數據�。獲得的臨床試驗數據用于產品臨床評價過程且為臨床證據的一部分。
例如,對于特定申報產品����,其已有同品種產品在中國獲準注冊,申報產品與同品種產品存在差異���。若注冊申請人基于申報產品的非臨床研究數據以及同品種產品的臨床數據對產品實施了全面的臨床評價���,但仍不能證明申報產品符合醫(yī)療器械安全和性能的基本原則,則可能需要開展臨床試驗���。
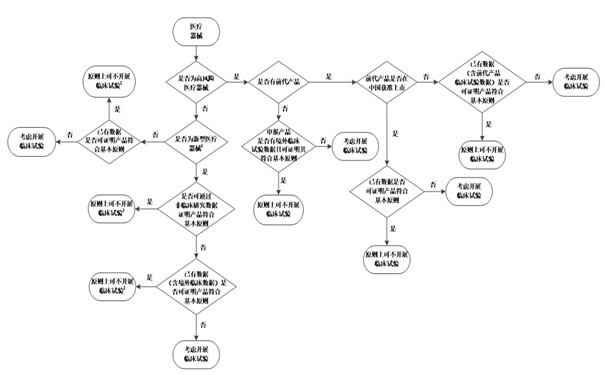
當注冊申請人根據以上因素考慮是否開展醫(yī)療器械臨床試驗時����,可參考《醫(yī)療器械臨床試驗決策流程圖》���。
附件:醫(yī)療器械臨床試驗決策流程圖