2023年10月25日��,國家藥監(jiān)局發(fā)布《中醫(yī)脈診設備產(chǎn)品注冊審查指導原則(征求意見稿)》,相比2016年天津藥監(jiān)局發(fā)布的指導原則���,此版本變動較大��,特別是允許采用同品種比對臨床評價方式完成中醫(yī)脈診設備的的臨床評價�����,一起看正文。
2023年10月25日�����,國家藥監(jiān)局發(fā)布《中醫(yī)脈診設備產(chǎn)品注冊審查指導原則(征求意見稿)》�����,相比2016年天津藥監(jiān)局發(fā)布的指導原則�,此版本變動較大,特別是允許采用同品種比對臨床評價方式完成中醫(yī)脈診設備的的臨床評價�����,一起看正文����。
中醫(yī)脈診設備產(chǎn)品注冊審查指導原則(征求意見稿)
本指導原則旨在指導注冊申請人對中醫(yī)脈診設備注冊申報資料的準備及撰寫��,同時也為技術審評部門審查注冊申報資料提供參考��。
本指導原則是對中醫(yī)脈診設備的一般要求�����,申請人應依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用��。若不適用�,需具體闡述理由及相應的科學依據(jù)�,并依據(jù)產(chǎn)品的具體特性對注冊申報資料的內(nèi)容進行充實和細化。
本指導原則是供注冊申請人和技術審評人員使用的指導性文件��,但不包括審評審批所涉及的行政事項�,亦不作為法規(guī)強制執(zhí)行,應在遵循相關法規(guī)的前提下使用本指導原則�����。如果有能夠滿足相關法規(guī)要求的其他方法��,也可以采用��,但是需要提供詳細的研究資料和驗證資料。
本指導原則是在現(xiàn)行法規(guī)和標準體系以及當前認知水平下制定����,隨著法規(guī)和標準的不斷完善,以及科學技術的不斷發(fā)展�,相關內(nèi)容也將適時進行調(diào)整。
一�、適用范圍
本指導原則適用于中醫(yī)脈診設備。根據(jù)《醫(yī)療器械分類目錄》���,申報產(chǎn)品的管理分類為Ⅱ類,管理代號為20中醫(yī)器械-01中醫(yī)診斷設備-01脈診設備��,指通常由主機��、加壓裝置和壓力傳感器組成����。經(jīng)壓力傳感器通過皮表對橈動脈及周邊組織的腕部寸、關��、尺部位以無創(chuàng)的方式��,在施加外力的條件下進行脈圖采集的設備����。本指導原則同樣適用于中醫(yī)臨床用于采集����、存儲脈象數(shù)據(jù)���,計算脈象參數(shù)特征信息的設備�����。其他包含中醫(yī)脈圖數(shù)據(jù)采集��、存儲與參數(shù)計算功能的組合式醫(yī)療器械的相關部分可參考本指導原則的適用部分�。
二��、注冊審查要點
(一)監(jiān)管信息
注冊申請人(以下簡稱申請人)需要描述申報產(chǎn)品的管理類別�����、分類編碼�、產(chǎn)品名稱的確定依據(jù)。
1.產(chǎn)品名稱
產(chǎn)品的命名應符合《醫(yī)療器械通用名稱命名規(guī)則》和國家標準�����、行業(yè)標準上的通用名稱要求。參照《醫(yī)療器械通用名稱命名指導原則》確定產(chǎn)品名稱��,產(chǎn)品名稱由一個核心詞和不超過三個的特征詞組成���,如“脈象診測信息采集系統(tǒng)”�、“中醫(yī)脈象診斷系統(tǒng)”����、“脈診儀”、“脈象儀”���。若產(chǎn)品具有其他性能特征�����,如加壓壓力與采集位置可調(diào)、數(shù)據(jù)存儲傳輸?shù)刃阅芸审w現(xiàn)在產(chǎn)品技術要求中�����,不必體現(xiàn)在產(chǎn)品名稱中����。
2.分類編碼
根據(jù)《醫(yī)療器械分類目錄》�����,分類編碼為20-01-01�����,管理類別為Ⅱ類���。
3.注冊單元劃分的原則和實例
注冊單元劃分應符合《醫(yī)療器械注冊單元劃分指導原則》的要求,原則上以申報產(chǎn)品的技術原理��、結(jié)構(gòu)組成和適用范圍為劃分依據(jù)�����。性能差異較大���、核心功能的實現(xiàn)原理差異較大�、結(jié)構(gòu)組成差異較大的應考慮劃分為不同的注冊單元����。
例如:按照產(chǎn)品的工作方式區(qū)分為臺車/便攜/可穿戴式需劃分為不同的注冊單元。按照主機類型是硬件控制型/軟件控制型需劃分為不同的注冊單元��。按照產(chǎn)品的加壓方式區(qū)分為氣動加壓/電機加壓/手動加壓需劃分為不同的注冊單元。按照脈圖數(shù)據(jù)采集傳感器的工作原理不同需劃分為不同的注冊單元����。按照產(chǎn)品的預期用途不同需劃分為不同的注冊單元。
(二)綜述資料
1.概述
申請人需描述中醫(yī)脈診設備的通用名稱及確定依據(jù)���、產(chǎn)品適用范圍���。如適用,申請人應提供設備的背景信息概述����。
2.產(chǎn)品描述
2.1設備的結(jié)構(gòu)組成
中醫(yī)脈診設備包含壓力傳感器、加壓裝置�、數(shù)據(jù)采集部件。不同類型的脈診產(chǎn)品可能包含:電腦主機����、軟件����、顯示設備,以及其他為實現(xiàn)中醫(yī)脈象數(shù)據(jù)采集��、存儲、計算功能而配合使用的模塊或部件�����。
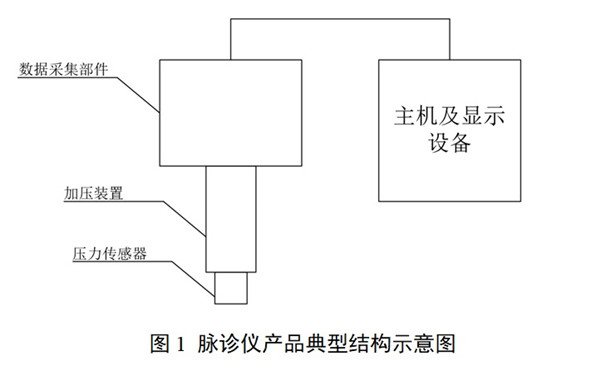
申請人應對產(chǎn)品構(gòu)造進行描述�,包括主要結(jié)構(gòu)組成和關鍵部件,并給出各個模塊的詳細文字或者圖片的說明與標識����。
2.2工作原理
中醫(yī)脈診設備通過加壓裝置將壓力傳感器壓至腕部橈動脈寸、關���、尺部位�����,并施加不同的壓力��,通過數(shù)據(jù)采集部件采集脈象數(shù)據(jù)���。通過其他配合使用的模塊實現(xiàn)對中醫(yī)脈象數(shù)據(jù)的采集、存儲�、計算等功能。
按照同時采集脈搏信號的個數(shù)分為單點��、三點、多點傳感器���。
按照操作方式分為自動加壓和手動加壓��,手動加壓為操作者采用手動的方式操作加壓裝置�����,實現(xiàn)申報產(chǎn)品施加在橈動脈采集位置的壓力變化����。自動加壓為申報產(chǎn)品可以通過電子裝置實現(xiàn)施加在橈動脈采集位置的壓力變化��。
根據(jù)加壓裝置的工作原理�,自動加壓一般分為氣動加壓和電機加壓兩種方式。氣動加壓裝置通過可調(diào)節(jié)內(nèi)部壓力的氣囊與傳感器連接�,通過改變氣囊內(nèi)壓強來推動壓力傳感器,實現(xiàn)不同壓力下采集脈圖數(shù)據(jù)�。電機加壓裝置通過電機推動壓力傳感器實現(xiàn)不同壓力下采集脈圖數(shù)據(jù)。
申請人應根據(jù)申報產(chǎn)品特點明確加壓裝置的工作原理����、加壓裝置與壓力傳感器的連接方式���。如申報產(chǎn)品預期用途包含對脈圖數(shù)據(jù)的計算和存儲功能�,需明確申報產(chǎn)品工作時所依據(jù)的脈診理論來源,列出具有說服力的中醫(yī)診斷教材或者已發(fā)表的論文著作���。對于實現(xiàn)預期用途的方法以及數(shù)據(jù)存儲的情況進行描述�,并說明采用該方法的原因和理論基礎�。產(chǎn)品功能原理見圖2。
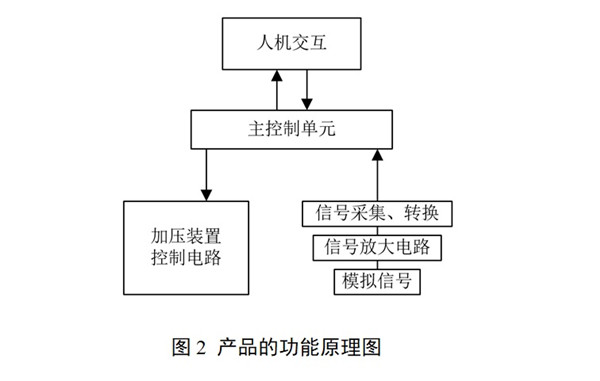
2.3型號規(guī)格
申請人需要詳細說明申報產(chǎn)品的型號規(guī)格�����,如申報產(chǎn)品存在多個型號規(guī)格或配置����,需要詳細說明各個型號規(guī)格、配置之間的差異�,包括:結(jié)構(gòu)組成、技術特征��、性能指標�����、工作方式、適用范圍�、使用環(huán)境等內(nèi)容。申請人需要以對比表格的形式�����,附帶詳細的文字和圖片解釋不同型號規(guī)格之間的差異���。
2.4包裝說明
申請人應詳細描述申報產(chǎn)品中注冊單元所有產(chǎn)品組成的包裝情況�����,說明包裝清單和包裝方式��,提供包裝圖示���。
2.5研發(fā)歷程
如適用,應描述申報產(chǎn)品的研發(fā)背景和目的���,如申報產(chǎn)品的研發(fā)歷史概述��、歷次注冊申請?zhí)峤坏男畔?��。此外��,還應在研發(fā)背景中描述產(chǎn)品改進的內(nèi)容�、實現(xiàn)方式�����、解決的技術問題或臨床問題等�����。
2.6與同類和/或前代產(chǎn)品的參考和比較
對于研發(fā)參考的同類產(chǎn)品或前代產(chǎn)品�,應說明選擇其作為研發(fā)參考的原因���。同時列表說明申報產(chǎn)品與研發(fā)參考產(chǎn)品在工作原理�����、結(jié)構(gòu)組成��、性能指標及適用范圍等方面的異同����。
區(qū)別于其他同類產(chǎn)品的特征是技術審評的關注點�,如設備適用范圍、結(jié)構(gòu)組成、性能指標等�����。
3.適用范圍和禁忌證
3.1適用范圍
申請人應依據(jù)臨床評價資料并結(jié)合相關臨床診療規(guī)范來明確申報產(chǎn)品的適用范圍���。
中醫(yī)脈診設備的預期用途應體現(xiàn)其臨床應用范圍��。應與醫(yī)療器械注冊申請表����、綜述資料����、臨床評價資料、產(chǎn)品風險分析資料�����、產(chǎn)品說明書等方面闡述保持一致�。例如:用于中醫(yī)脈診。
3.2預期使用環(huán)境
申請人應詳細描述申報產(chǎn)品的使用環(huán)境和產(chǎn)品保存環(huán)境要求��。包括:產(chǎn)品的貯存���、運輸和使用環(huán)境的溫度��、濕度等要求�。
3.3適用人群與禁忌證
申請人應說明申報產(chǎn)品適用人群的標準。中醫(yī)脈診設備一般不適用于以下人群:
(1)腕關節(jié)損傷��、腕部皮膚過敏或破損者�����;
(2)橈動脈搏動消失(無脈癥)患者��,橈動脈解剖位置異常(斜飛脈或反關脈)患者����;
(3)肢體震顫��,如帕金森患者���;
4.申報產(chǎn)品上市歷史
如適用���,申請人需提供以下相關資料:
4.1上市情況。申報產(chǎn)品在各國家或地區(qū)的上市批準時間�、銷售情況����。
4.2不良事件和召回���。
4.3銷售��、不良事件及召回率�。
5.其他需說明的內(nèi)容
若適用����,申請人可以提供申報產(chǎn)品需要重點關注的其他內(nèi)容和支持性資料。
(三)非臨床資料
1. 產(chǎn)品風險管理資料
應符合GB/T 42062《醫(yī)療器械風險管理對醫(yī)療器械的應用》的有關要求�。
2. 醫(yī)療器械安全和性能基本原則清單
申請人應提供《醫(yī)療器械安全和性能基本原則清單》,并說明申請產(chǎn)品為了符合適用的各項要求所采用的方法�,并提供相關文件。
3. 產(chǎn)品技術要求及檢驗報告
3.1申報產(chǎn)品適用標準情況
注冊申請人需列表說明申報產(chǎn)品執(zhí)行和參考的國家標準和行業(yè)標準��。
中醫(yī)脈診設備適用的標準為:YY/T 1489《中醫(yī)脈圖采集設備》���,電氣安全應符合GB 9706.1的要求����,電磁兼容應符合YY 9706.102的要求���。
3.2產(chǎn)品技術要求
注冊申請人應按照《醫(yī)療器械產(chǎn)品技術要求編寫指導原則》編寫產(chǎn)品技術要求����,結(jié)合申報產(chǎn)品的特點設置條款。
產(chǎn)品技術要求明確產(chǎn)品規(guī)格型號及劃分說明���。要注明軟件發(fā)布版本�、軟件版本命名規(guī)則��,其中軟件版本命名規(guī)則需與質(zhì)量管理體系保持一致�����。
產(chǎn)品技術指標可參考YY/T 1489《中醫(yī)脈圖采集設備 》���。
(1)工作條件。
(2)外加力學量施加裝置的安全限值�。
(3)外加力學量的準確性。
(4)脈壓準確性����。
(5)脈率準確性。
(6)泄壓功能�。
(7)傳感器有效幾何尺寸����。
(8)動態(tài)放大器的時間常數(shù)����。
(9)工作噪聲。
(10)外觀����。
除參考行業(yè)標準YY/T 1489的要求外,軟件功能及網(wǎng)絡安全應根據(jù)產(chǎn)品的實際情況編寫���。電氣安全應符合GB 9706.1的要求���;電磁兼容應符合YY9706.102的要求。
3.3檢驗報告
注冊申請人應提供產(chǎn)品檢驗報告�,產(chǎn)品檢驗報告應符合國務院藥品監(jiān)督管理部門的要求,可以是醫(yī)療器械注冊申請人的自檢報告�����,也可以是委托具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構(gòu)出具的檢驗報告�����。
檢驗報告提供軟件版本界面照片或列明軟件版本信息,有用戶界面的軟件體現(xiàn)軟件發(fā)布版本�、軟件完整版本,無用戶界面的軟件體現(xiàn)軟件完整版本��。
同一注冊單元內(nèi)注冊檢驗代表產(chǎn)品確定原則和實例��。
用于檢驗產(chǎn)品應當能夠代表申請注冊產(chǎn)品的安全性和有效性�,應充分考慮產(chǎn)品功能、結(jié)構(gòu)組成����、控制方式及其他風險等方面;代表產(chǎn)品應是功能�����、配置最齊全����、結(jié)構(gòu)最復雜��、風險最高的產(chǎn)品�����。
注冊單元內(nèi)各型號的主要安全指標、性能指標不能被代表型號全部涵蓋時���,則應選擇涵蓋安全指標�����、性能指標最多的產(chǎn)品作為代表產(chǎn)品��,還應考慮其他型號中未被代表型號所涵蓋的安全指標及性能指標�。
與性能和安全項目關注點不同�����,電磁兼容方面的典型性產(chǎn)品應充分考慮注冊單元內(nèi)不同型號之間電磁兼容特點和差異��。
4. 研究資料
除根據(jù)申報產(chǎn)品適用范圍和技術特征提供非臨床研究綜述外��,還應針對中醫(yī)脈診設備產(chǎn)品的具體特點����,提供產(chǎn)品使用準確性的研究資料,如:數(shù)據(jù)采集準確性研究�、數(shù)據(jù)分析準確性研究等。
4.1生物相容性研究
依據(jù) GB /T 16886.1標準要求開展生物學評價。按照患者和使用者直接接觸具體部件進行相應的評價�����。設備一般與人體皮膚接觸的部件有傳感器�、加壓裝置、輔助采集模塊����。例如,傳感器與腕部皮膚短期接觸���,按照GB /T 16886.1標準的要求�,生物相容性評價至少應考慮以下方面的要求:細胞毒性���、致敏��、皮膚刺激���。對不同接觸類型的部件應分別進行評價�����。豁免進行試驗的項目宜給出充分理由和論證����。
4.2軟件研究
產(chǎn)品結(jié)構(gòu)組成中若包含作為醫(yī)療器械組成部分的軟件,應參照《醫(yī)療器械軟件注冊審查指導原則(2022年修訂版)》的要求提供研究資料���,內(nèi)容包括基本信息����、實現(xiàn)過程�����、核心功能��、結(jié)論等內(nèi)容��,詳盡程度取決于軟件安全性級別����,該類產(chǎn)品一般為中等。其中��,基本信息包括軟件標識����、安全性級別���、結(jié)構(gòu)功能、物理拓撲�、運行環(huán)境、注冊歷史�����,實現(xiàn)過程包括開發(fā)概況���、風險管理����、需求規(guī)范��、生存周期�、驗證與確認、可追溯性分析�、缺陷管理、更新歷史����,明確核心功能����、核心算法��、預期用途的對應關系��。軟件功能的驗證與確認至少應體現(xiàn)適用范圍中宣稱的測量功能��,且應當與其它申報資料保持一致�。
產(chǎn)品若具備電子數(shù)據(jù)交換��、遠程控制或用戶訪問功能的獨立軟件和含有軟件組件的產(chǎn)品���,應當參照《醫(yī)療器械網(wǎng)絡安全注冊審查指導原則(2022年修訂版)》提供研究資料�,基本信息包括軟件信息��、數(shù)據(jù)架構(gòu)���、網(wǎng)絡安全能力����、網(wǎng)絡安全補丁����、安全軟件����,實現(xiàn)過程包括風險管理�、需求規(guī)范、驗證與確認����、可追溯性分析、更新維護計劃����,漏洞評估明確已知漏洞相關信息。應提交網(wǎng)絡安全描述文檔���,并在產(chǎn)品技術要求中規(guī)定相應的性能指標�����。
通過電子接口與其他醫(yī)療器械或非醫(yī)療器械交換并使用信息���,應提供互操作性研究資料,包括基本信息�、需求規(guī)范�、風險管理���、驗證與確認�、維護計劃等內(nèi)容����。
4.3清潔消毒研究
申請人應開展清潔消毒研究�����。申報產(chǎn)品在使用前應對與患者接觸部件進行清潔消毒處理�����。應當明確推薦的清洗和消毒工藝(方法和參數(shù))�、工藝的確定依據(jù)以及驗證的相關研究資料。
5. 穩(wěn)定性研究
使用期限一般主要取決于使用過程中部件����、元器件的損耗、老化等�����,注冊申請人應按照聲稱的使用期限對設備進行老化/疲勞試驗,也可對影響設備使用期限的關鍵部件進行老化/疲勞試驗�,例如設備中不可更換(或更換成本高)的部件,并提供相應的研究資料��。研究資料應能證明上述部件按照所聲稱的使用期限���,經(jīng)過老化/疲勞試驗后�,產(chǎn)品性能和安全仍符合預期的要求��。使用期限也可基于已有數(shù)據(jù)進行合理的推斷���、分析����、計算得出���,但應提供詳細的說明及支持性資料�����?����?蓞⒖肌队性瘁t(yī)療器械使用期限技術審查指導原則》的要求����。
注冊申請人對包裝和產(chǎn)品進行模擬試驗,模擬在貯存和運輸過程中���,遇到極端情況時����,例如環(huán)境(溫濕度�����、氣壓等)變化�����、跌落�����、振動����、加速度等,產(chǎn)品不會發(fā)生性能���、功能改變����,包裝系統(tǒng)具有保護產(chǎn)品的能力���。經(jīng)過模擬試驗后�,觀察包裝外觀是否有不可接受的異?�,F(xiàn)象����,對產(chǎn)品進行性能測試,證明運輸和環(huán)境測試后產(chǎn)品能夠保持其完整性和功能性�。環(huán)境試驗可參考GB/T14710的要求。
(四)臨床評價資料
中醫(yī)脈診設備的臨床評價應遵循該類產(chǎn)品研發(fā)的基本規(guī)律以及中醫(yī)理論和實踐��,通過科學的過程來評估產(chǎn)品臨床療效和潛在風險�,最終確定產(chǎn)品在預期用途下的安全性和有效性,并為產(chǎn)品使用說明書的撰寫提供依據(jù)���。
申請人可參考《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》《醫(yī)療器械臨床評價技術指導原則》《醫(yī)療器械等同性論證技術指導原則》《決策是否開展醫(yī)療器械臨床試驗技術指導原則》等相關要求開展中醫(yī)脈診設備的臨床評價并提供臨床評價資料���。
臨床評價資料應包含:
1.產(chǎn)品描述和研發(fā)背景:包括申報產(chǎn)品基本信息�����、適用范圍�、現(xiàn)有的診斷或治療方法及涉及醫(yī)療器械的臨床應用情況�����、申報產(chǎn)品與現(xiàn)有診斷或治療方法的關系�、預期達到的臨床療效等。
2.明確臨床評價涵蓋的范圍�,申報產(chǎn)品中如有可免于進行臨床評價的部分�,描述其結(jié)構(gòu)組成并說明免于進行臨床評價的理由。
3.臨床評價路徑:根據(jù)申報產(chǎn)品的適用范圍�、技術特征、已有臨床數(shù)據(jù)等具體情況����,選擇恰當?shù)呐R床評價路徑,包括同品種臨床評價路徑和/或臨床試驗路徑���。
4.若通過同品種臨床評價路徑進行臨床評價�����,應當提交申報產(chǎn)品與同品種醫(yī)療器械在適用范圍��、技術特征���、生物學特性方面的對比資料����;應當對同品種醫(yī)療器械的臨床數(shù)據(jù)進行收集�、評估和分析,形成臨床證據(jù)���。如適用�,應當描述申報產(chǎn)品與同品種醫(yī)療器械的差異��,提交充分的科學證據(jù)證明二者具有相同的安全有效性��。
5.若通過臨床試驗路徑進行臨床評價�,應當提交臨床試驗方案、臨床試驗機構(gòu)倫理委員會同意開展臨床試驗的書面意見�、臨床試驗報告�����、知情同意書樣本���,并附臨床試驗數(shù)據(jù)庫(原始數(shù)據(jù)庫、分析數(shù)據(jù)庫�����、說明性文件和程序代碼)����。
建議申請人結(jié)合中醫(yī)脈診設備的風險和受益,選擇合理的臨床評價路徑���,論證其臨床應用的安全有效性����。
(五)產(chǎn)品說明書和標簽樣稿
申報產(chǎn)品的說明書�、標簽樣稿應當符合《醫(yī)療器械說明書和標簽管理規(guī)定》以及GB 9706.1��、YY 9706.102中有關要求�����,除此之外,說明書中還應包含以下內(nèi)容:
1.明確申報設備的消毒方式��。
2.明確申報設備的有效期�。
3.應說明申報設備的安裝、拆卸�����、更換方式����。
4.使用說明任何意外情況時,操作者快速安全地從患者身上移除脈象采集設備的加壓裝置的操作步驟及方法�����。
產(chǎn)品說明書的內(nèi)容均應有明確的來源�,與綜述資料、研究資料及產(chǎn)品技術要求等注冊申報資料的內(nèi)容保持一致��。說明書中涉及技術內(nèi)容且產(chǎn)品技術要求中未包含的��,應提交相應驗證資料��。
產(chǎn)品說明書還需結(jié)合產(chǎn)品特點明確以下內(nèi)容:
(1)設備的注意事項及警告信息。
(2)明確“本產(chǎn)品須在醫(yī)療機構(gòu)中使用��,在使用前請務必詳細閱讀使用說明書”����。
(3)設備電磁兼容的相關信息。應給出設備電磁兼容信息的相關說明及工作環(huán)境��。
(六)質(zhì)量管理體系文件
產(chǎn)品的質(zhì)量管理體系文件應符合《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》的要求����,并按《醫(yī)療器械注冊申報資料要求及說明》提交資料。
應明確產(chǎn)品生產(chǎn)工藝過程�����,可采用流程圖的形式����,并說明其過程控制點,且應結(jié)合產(chǎn)品實際生產(chǎn)過程細化產(chǎn)品生產(chǎn)工藝介紹����,應能體現(xiàn)出外協(xié)加工部分(如有)�、半成品加工過程���,工藝流程圖中應明示關鍵工序、特殊過程(如有)�、過程控制點、各生產(chǎn)檢驗工序?qū)Νh(huán)境的要求���、使用的相關設備及對設備精度的要求等相關信息��。
應詳細介紹研制場地���、生產(chǎn)場地情況,并應結(jié)合前面介紹的產(chǎn)品加工工藝����,以及工序和工位的劃分、預計產(chǎn)量�����、生產(chǎn)線劃分等實際需求細化研發(fā)���、生產(chǎn)��、檢驗���、庫房場地面積�、環(huán)境控制等相關情況說明���。
若產(chǎn)品有多個研制�����、生產(chǎn)場地�����,應概述每個研制�����、生產(chǎn)場地的實際情況����。
如有中醫(yī)脈診儀注冊服務需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡,聯(lián)系人:葉工,電話:18058734169�����,微信同���。