2023年12月19日�,上海藥品監(jiān)督管理局公開(kāi)了上海科賜醫(yī)療技術(shù)有限公司的第二類醫(yī)療器械產(chǎn)品注冊(cè)(一次性使用食管牽開(kāi)球囊導(dǎo)管)的注冊(cè)審評(píng)報(bào)告��。一起來(lái)關(guān)注這個(gè)有代表性產(chǎn)品的特點(diǎn)及審評(píng)情況���。
2023年12月19日��,上海藥品監(jiān)督管理局公開(kāi)了上??瀑n醫(yī)療技術(shù)有限公司的第二類醫(yī)療器械產(chǎn)品注冊(cè)(一次性使用食管牽開(kāi)球囊導(dǎo)管)的注冊(cè)審評(píng)報(bào)告���。一起來(lái)關(guān)注這個(gè)有代表性產(chǎn)品的特點(diǎn)及審評(píng)情況�。

一����、產(chǎn)品概述
(一)產(chǎn)品結(jié)構(gòu)及組成SAFER-A480s�、SAFER-A520s 由牽開(kāi)球囊組件、鞘管套件���、鞘管輔助器��、三通閥�����、延長(zhǎng)管�、固定頭帶和石蠟棉球組成;石蠟棉球采用具有有效醫(yī)療器械注冊(cè)產(chǎn)品��。SAFER-B480��、SAFER-B520 由牽開(kāi)球囊組件���、鞘管套件�、鞘管輔助器���、三通閥�����、延長(zhǎng)管和石蠟棉球組成��;石蠟棉球采用具有有效醫(yī)療器械注冊(cè)產(chǎn)品��。產(chǎn)品經(jīng)環(huán)氧乙烷滅菌�����,一次性使用�����,貨架有效期2 年���。
(二)產(chǎn)品適用范圍本產(chǎn)品適用于心臟消融手術(shù)過(guò)程中牽開(kāi)食管���。
(三)型號(hào)/規(guī)格一次性使用食管牽開(kāi)球囊導(dǎo)管產(chǎn)品型號(hào)規(guī)格包括SAFER-A480s、SAFER-A520s�����、SAFER-B480���、SAFER-B520���。
(四)工作原理一次性使用食管牽開(kāi)球囊導(dǎo)管產(chǎn)品采用可彎曲的偏心球囊結(jié)構(gòu)���,在心臟電生理介入消融手術(shù)的過(guò)程中�����,將彎曲球囊送入食管與心臟相鄰的位置����,在保證球囊彎曲度和剛性的條件下,以主動(dòng)干預(yù)的方式��,帶動(dòng)食管彎曲�����,從而遠(yuǎn)離心臟消融的位置���,阻斷消融溫度傳遞到食管���。
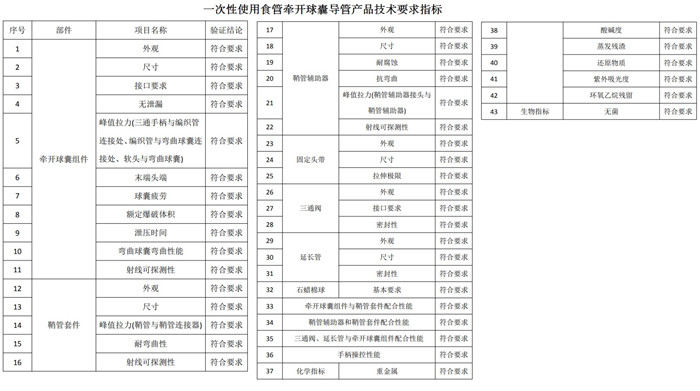
二、一次性使用食管牽開(kāi)球囊導(dǎo)管注冊(cè)產(chǎn)品技術(shù)要求
產(chǎn)品技術(shù)要求研究產(chǎn)品技術(shù)要求研究項(xiàng)目如下圖所示:
三�����、生物相容性
一次性使用食管牽開(kāi)球囊導(dǎo)管牽開(kāi)球囊組件��、鞘管套件、鞘管輔助器�����、三通閥����、延長(zhǎng)管、固定頭帶和石蠟棉球組成����,其中彎曲球囊、鞘管套件���、鞘管輔助器��,與人體自然腔道(鼻腔和食管黏膜)接觸�����;三通閥����、延長(zhǎng)管��、固定頭帶��,與人體皮膚接觸��。申請(qǐng)人按照 GB/T 16886 系列標(biāo)準(zhǔn)對(duì)所有部件分別進(jìn)行了生物相容性評(píng)價(jià)�,產(chǎn)品的生物相容性風(fēng)險(xiǎn)可接受
四、滅菌
該產(chǎn)品以無(wú)菌狀態(tài)提供���,采用環(huán)氧乙烷滅菌�,申請(qǐng)人提供了滅菌確認(rèn)報(bào)告����,證明無(wú)菌保證水平為 10-6,環(huán)氧乙烷殘留量不大于10μg/g��。
五����、產(chǎn)品有效期和包裝
該產(chǎn)品貨架有效期為 2 年。申請(qǐng)人提供了貨架有效期驗(yàn)證報(bào)告�,驗(yàn)證試驗(yàn)為加速老化驗(yàn)證,包括產(chǎn)品穩(wěn)定性驗(yàn)證���、包裝完整性和模擬運(yùn)輸驗(yàn)證����。
六、臨床評(píng)價(jià)概述
該產(chǎn)品采用臨床試驗(yàn)路徑進(jìn)行臨床評(píng)價(jià)��,采用前瞻性���、多中心���、單組目標(biāo)值對(duì)照試驗(yàn)設(shè)計(jì),以驗(yàn)證該產(chǎn)品的安全性及有效性��。試驗(yàn)共入組 122 例受試者����。主要有效性評(píng)價(jià)指標(biāo)為:消融線與食管不重合率;次要有效性評(píng)價(jià)指標(biāo)為:操作滿意度���;安全性評(píng)價(jià)指標(biāo)為:食管機(jī)械性損傷����、不良事件和嚴(yán)重不良事件���。該臨床試驗(yàn)共在 9 家臨床機(jī)構(gòu)開(kāi)展���,納入統(tǒng)計(jì)全分析集(FAS)119 例����,符合方案集(PPS)119 例����。
臨床試驗(yàn)結(jié)果顯示:
(1)主要有效性評(píng)價(jià)指標(biāo)使用試驗(yàn)產(chǎn)品進(jìn)行食管牽移后��,消融線與食管不重合率及其置信區(qū)間為95.8%(90.47%-98.62%)��,置信區(qū)間下限大于目標(biāo)值80%����,提示試驗(yàn)成功。
(2)次要有效性評(píng)價(jià)指標(biāo)試驗(yàn)產(chǎn)品的操作滿意度����,評(píng)分為 5 分的占比85.7%,評(píng)分為4分的占比 13.4%�,評(píng)分為 3 分的占比 0.8%,提示試驗(yàn)產(chǎn)品的操作可行性良好����。
(3)安全性評(píng)價(jià)指標(biāo)本研究試驗(yàn)期間未發(fā)生嚴(yán)重的器械相關(guān)不良事件�����、未發(fā)生導(dǎo)致退出的不良事件���、未發(fā)生導(dǎo)致退出的器械相關(guān)不良事件。綜上����,臨床評(píng)價(jià)資料符合目前臨床審評(píng)要求。