摘要:繼生產(chǎn)�、流通、使用環(huán)節(jié)的抽檢之后�,醫(yī)療器械臨床試驗抽檢已經(jīng)在全國各地開展。以下是2016年至今2018年總局三年內(nèi)的醫(yī)療器械臨床抽檢公告進行了總結(jié)���。

一�、硝煙彌漫的戰(zhàn)場
2016年,CFDA抽取20個項目開展臨床試驗現(xiàn)場檢查��,8個存在真實性問題����。
2017年,CFDA抽取19個項目開展臨床試驗現(xiàn)場檢查�,3個存在真實性問題。
2018年���,截止目前�,CFDA抽取20個項目開展臨床試驗現(xiàn)場檢查��,9個有合規(guī)性問題�,未公布有真實性問題(請注意第二批10個項目結(jié)果尚未公布,但我司項目已傳佳績)�。
各省局臨床核查也已開展多年,如廣東�、北京、上海�、江蘇、廣西���、浙江�����、湖南�、天津�、遼寧、河南�����、安徽��、四川��、山西……
不幸的是:在核查通告中����,我們不難發(fā)現(xiàn)IVD問題較多,是“重災區(qū)”��。
我們還發(fā)現(xiàn):目前開展的臨床試驗監(jiān)督抽查不僅關注的是在注冊項目�,還包括備案后現(xiàn)處于試驗中的項目。
由此可見�����,監(jiān)管部門對臨床核查有著強大的決心、恒心��、專心�。
寫到此,心情沉重��,小編覺得“質(zhì)量保證��,準時交付”不僅是我們給客戶����、公司的承諾,更是我們部門給自己的“軍令狀”:
a)確保臨床進度時���,同時也要做好質(zhì)量控制和質(zhì)量保證����;
b)法規(guī)要求絕不是“優(yōu)秀線”��,勉強算上“及格線”��;
c)臨床試驗的質(zhì)量不是操作出來的���,而是設計出來的�����;
d)加強臨床試驗管理�����,才能保證試驗規(guī)范��,才能使得產(chǎn)品安全性和有效性可信��,才能維護好受試者的權益��。
二����、臨床試驗質(zhì)量控制法規(guī)依據(jù)
三��、臨床試驗監(jiān)督抽查內(nèi)容
目前臨床監(jiān)督抽查主要是圍繞臨床試驗的真實性和合規(guī)性開展��。依據(jù) 2018年11月28日發(fā)布《醫(yī)療器械臨床試驗檢查要點及判定原則》(藥監(jiān)綜械注〔2018〕45號)���,根據(jù)檢查發(fā)現(xiàn)的問題����,檢查結(jié)果按以下原則判定。
3.1 有以下情形之一的��,判定為存在真實性問題:
(1)編造受試者信息�、主要試驗過程記錄、研究數(shù)據(jù)��、檢測數(shù)據(jù)等臨床試驗數(shù)據(jù)��,影響醫(yī)療器械安全性�、有效性評價結(jié)果的;
(2)臨床試驗數(shù)據(jù)�,如入選排除標準、主要療效指標�����、重要的安全性指標等不能溯源的�;
(3)試驗用醫(yī)療器械不真實,如以對照用醫(yī)療器械替代試驗用醫(yī)療器械�、以試驗用醫(yī)療器械替代對照用醫(yī)療器械,以及以其他方式使用虛假試驗用醫(yī)療器械的��;
(4)瞞報與臨床試驗用醫(yī)療器械相關的嚴重不良事件和可能導至嚴重不良事件的醫(yī)療器械缺陷、使用方案禁用的合并用藥或醫(yī)療器械的����;
(5)注冊申請的臨床試驗報告中數(shù)據(jù)與臨床試驗機構保存的臨床試驗報告中的數(shù)據(jù)不一致,影響醫(yī)療器械安全性��、有效性評價結(jié)果的�;
(6)注冊申請的臨床試驗統(tǒng)計分析報告中數(shù)據(jù)與臨床試驗統(tǒng)計數(shù)據(jù)庫中數(shù)據(jù)或分中心臨床試驗小結(jié)中數(shù)據(jù)不一致,影響醫(yī)療器械安全性�、有效性評價結(jié)果的��;
(7)其他故意破壞醫(yī)療器械臨床試驗數(shù)據(jù)真實性的情形���。
3.2 未發(fā)現(xiàn)真實性問題的�����,但臨床試驗過程不符合醫(yī)療器械臨床試驗相關規(guī)定要求的���,判定為存在合規(guī)性問題。
3.3 未發(fā)現(xiàn)上述問題的���,判定為符合要求�。
四���、監(jiān)督抽查總結(jié)
下圖是2016~2018年臨床監(jiān)督抽查公告中的常見問題分析����。其中“核心文件”的整理是最令人頭疼的,此外���,“物資管理”�、“試驗數(shù)據(jù)”也是臨床真實性核查中最常見的問題���。
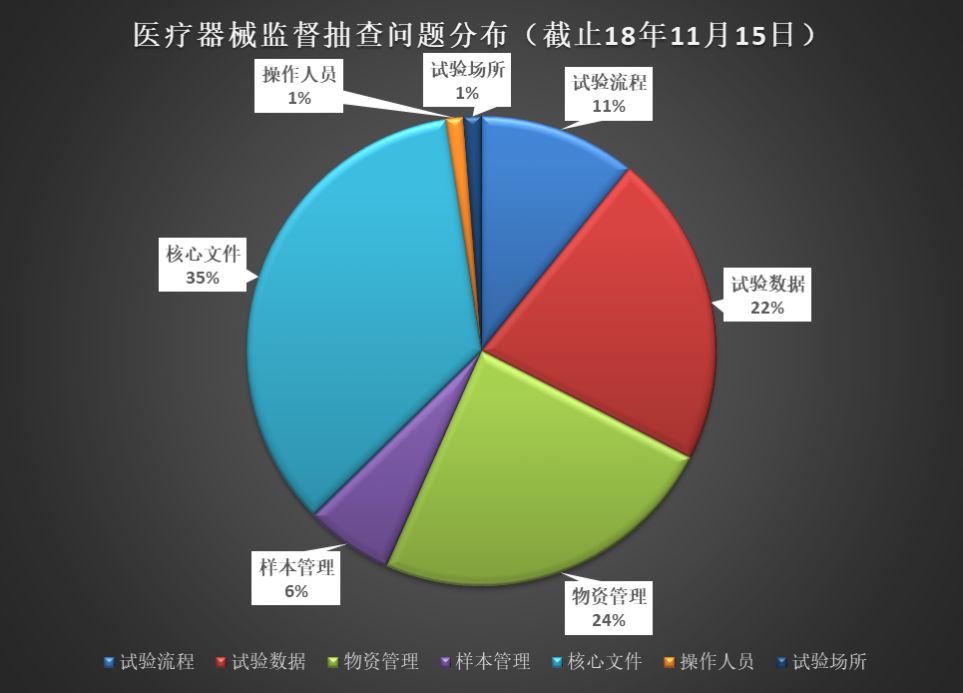
“核心文件”——藥監(jiān)局是有發(fā)目錄清單的(總局關于發(fā)布《醫(yī)療器械臨床試驗倫理審查申請與審批表范本》等六個文件的通告(2016年第58號):附件6.醫(yī)療器械臨床試驗應當保存的基本文件目錄)�。文件工作是最基本的工作���,實際檢查出來的情況確讓人堪憂����。如果連“文件工作”都做不好����,藥監(jiān)局的老師們?nèi)绾蜗嘈排R床試驗的合規(guī)性、真實性呢����?
基于此���,也請大家延伸思考2個問題:
a) 每一個臨床試驗參與者,會不會是另一個臨床試驗的受試者呢�����?
b) 每一個臨床試驗參與者���,會不會又是另一個產(chǎn)品經(jīng)過臨床試驗并被批準上市的最終使用者呢�����?
“物資管理”和“試驗數(shù)據(jù)”——均可以通過文件和記錄體現(xiàn)?�!夺t(yī)療器械臨床試驗質(zhì)量管理規(guī)范(25號令)》要求如下:
第78條所述“臨床試驗結(jié)束時�����,研究者應當確保完成各項記錄���、報告�。同時,研究者還應當確保收到的試驗用醫(yī)療器械與所使用的���、廢棄的或者返還的數(shù)量相符合�,確保剩余的試驗用醫(yī)療器械妥善處理并記錄存檔”���;
第80條所述“在臨床試驗中�����,研究者應當確保將任何觀察與發(fā)現(xiàn)均正確完整地予以記錄��,并認真填寫病例報告表”��;
第82條所述“申辦者應當準確����、完整地記錄與臨床試驗相關的信息”���。
通告中顯示不少項目缺失研究產(chǎn)品“交接記錄”��、“運輸記錄”��、“儲存條件”�、“分發(fā)記錄”、“使用記錄”�、“回收/銷毀記錄”,甚至還有記錄顯示試驗用樣本“已經(jīng)超過有效期”��,我們不禁要問“真的有做過臨床試驗嗎�����?”
另外���,同一個項目在不同臨床試驗機構被檢查出的問題基本是一致的����。究其根本原因��,需要考慮下是否是——臨床試驗申辦方及其代表(如CRO)對于臨床試驗態(tài)度的問題了——有些文件不是有就行了�����,如果忽略了時間關系和邏輯順序���,那么低級錯誤就會頻繁發(fā)生。
隨著監(jiān)管力度越嚴�����,如果大家還是抱有僥幸心理并企圖蒙混過關,總有一天會自食惡果�,因為“出來混終是要還的”。
小編在工作中無意發(fā)現(xiàn)����,有些機構老師根據(jù)通告做了《申辦方與醫(yī)院“黑名單”》,聲稱不與他們合作�����。碰到這種中心����,小編認為還是應該好好珍惜,當以自勉�����,互相學習�,早日進步為宜。
五����、通告案例問題歸納
5.1 臨床試驗機構方面
未經(jīng)審核同意在臨床試驗機構以外場所進行試驗���。
5.2 臨床試驗中實施者/申請人的職責履行情況
有非臨床試驗機構人員參與試驗設備操作。
5.3 臨床試驗的批準備案情況
(1) 研究者未全程參與臨床試驗方案的制定過程�����;
(2) 臨床試驗方案修訂未經(jīng)醫(yī)院倫理委員會���、申辦方�、主要研究者批準���;
(3) 方案無主要研究者��、統(tǒng)計學負責人簽字或無機構蓋章��;
(4) 方案無臨床試驗主管部門意見����、蓋章��。
5.4 倫理審查方面
(1) 倫理委員會批準的知情同意書����、CRF內(nèi)容與執(zhí)行的知情同意書、CRF內(nèi)容不一致�;
(2) 需要快審資料,未提供主審委員的快審審查意見�����;
(3) 倫理批件未見倫理委員會會議簽到表����;
(4) 倫理批件未標明臨床試驗方案和知情同意書的版本號;
(5) 知情同意書中缺少風險告知內(nèi)容��;
(6) 無合理理由家屬代簽知情同意書���。
5.5 臨床試驗準備情況
(1) 未按照試驗用醫(yī)療器械的預期用途進行方案設計�����;
(2) 臨床試驗方案編制不嚴謹����,前后不一致或者相互矛盾���;
(3) 《醫(yī)療器械臨床試驗須知》中無受試產(chǎn)品的技術指標等����;
(4) 病例未按照統(tǒng)計學原理進行選取,且抽查病例的干擾病例指標無法溯源�����;
(5) 未根據(jù)臨床試驗方案制定標準操作規(guī)程�����;
(6) 未提供臨床試驗質(zhì)控品交接和檢測記錄��;
(7) 未提供對照產(chǎn)品的相關資質(zhì)文件����;
(8) 多中心試驗中,參比試劑不同����;
(9) 臨床試驗記錄、表格���、文件等資料未簽署具體意見或未蓋章�����。
5.6 臨床試驗實施情況
(1) 未嚴格按照制定的臨床試驗方案開展試驗���;
(2) 受試者入組前未按方案要求完成全部檢測;
(3) 未開展預實驗;
(4) 監(jiān)查方案可操作性不強�,未能在監(jiān)查中及時發(fā)現(xiàn)問題。
(5) 未記錄合并用藥����;
(6) 臨床試驗樣本的存儲條件與實際不一致;
(7) 對比試劑的適用機型與試驗用儀器不符�����。
5.7 臨床試驗數(shù)據(jù)管理
(1) 原始病歷中相關記錄不全���;
(2) 臨床試驗相關圖像評估記錄不全����;
(3) 病例臨床試驗原始記錄未記錄修改原因和時間�;
(4) 樣本無篩選記錄;
(5) 項目培訓記錄不完全或缺失�����;
(6) 監(jiān)查記錄不完全或缺失;
(7) 病例報告表記錄不符合要求�����;
(8) 病例報告表表中數(shù)據(jù)與原始記錄不一致�����;
(9) 臨床試驗檢測數(shù)據(jù)無操作者���、復核者簽字確認等����;
(10) 漏報不良事件����、嚴重不良事件、器械缺陷等�����;
(11) 剔除數(shù)據(jù)無依據(jù)和說明����;
(12) 未記錄受試產(chǎn)品的失效日期等�����;
(13) 臨床試驗用設備使用記錄缺失。
5.8受試產(chǎn)品的管理
(1) 通過現(xiàn)場檢查和調(diào)取注冊申請資料還發(fā)現(xiàn)�,該注冊申請項目在開展臨床試驗前未提交該產(chǎn)品的型式試驗報告;
(2) 未提供受試產(chǎn)品����、對照產(chǎn)品的分發(fā)和回收記錄;
(3) 儀器交接記錄未保留快遞單號�;
(4) 試驗用樣本試劑交付給臨床試驗機構時已經(jīng)超過有效期。
5.9 臨床試驗用樣本的管理
(1) 樣本重復使用����,未提供相應說明;
(2) 樣本采集�、儲存、分發(fā)��、使用����、留樣、銷毀記錄不完全或缺失;
(3) 樣本類型不符�����、無法追溯�����。
5.10 申報資料的情況
(1) 倫理委員會保存的方案與注冊申報材料中的方案病例數(shù)和病例分配不一致����;
(2) 提交的注冊申請中的臨床試驗方案、報告與臨床試驗機構保存的臨床試驗方案����、報告簽章不一致;
(3) 臨床試驗用產(chǎn)品與注冊申報資料的臨床試驗方案和試驗報告中的產(chǎn)品為不一致��;
(4) 部分臨床數(shù)據(jù)與現(xiàn)場提供的統(tǒng)計分析數(shù)據(jù)不一致等����;
(5) 統(tǒng)計分析報告表未對剔除病例做出說明等;
(6) 臨床機構保存的可溯源的隨訪例數(shù)與注冊申報資料的臨床試驗總結(jié)報告隨訪例數(shù)不一致��。
小結(jié):限于篇幅問題����,小編就先寫到這了�。臨床試驗現(xiàn)場核查目前只是剛剛拉開帷幕��,作為正在或即將踏上臨床試驗征途的法規(guī)工作者�,我們要“冬練三九,夏練三伏”�,穩(wěn)扎穩(wěn)打,放眼全局�����。在進行臨床試驗時��,我們要保證質(zhì)量�,不要一味的追求進度而忽視質(zhì)量����,要遵循產(chǎn)品的自身特點和預期用途,要遵循相關法律法規(guī)和相關的SOP要求�,否則必將前功盡棄、玩火自焚����。
以上內(nèi)容只是小編的幾點薄見����,如若存在錯誤的地方�����,歡迎批評指正�����。