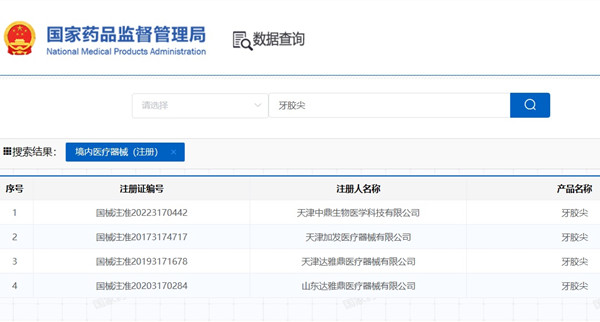
牙膠尖注冊(cè)產(chǎn)品為牙科固體根管填充材料�����,在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品����,目前取得醫(yī)療器械注冊(cè)證的企業(yè)非常少。牙膠尖通常由古塔膠�����、硫酸鋇、氧化鋅�、鈦白粉、碳酸鎂�����、硬脂酸��、滑石粉���、液體石蠟及顏料組成����,用于根管治療過程中與根管糊劑配合使用進(jìn)行根管充填�、封閉。2023年10月23日���,國(guó)家藥監(jiān)局發(fā)布《牙膠尖注冊(cè)審查指導(dǎo)原則(征求意見稿)》���,詳見正文。有意向開展牙膠尖注冊(cè)的醫(yī)療器械注冊(cè)人可關(guān)注本文件��。
牙膠尖注冊(cè)產(chǎn)品為牙科固體根管填充材料,在我國(guó)屬于第三類醫(yī)療器械注冊(cè)產(chǎn)品����,目前取得醫(yī)療器械注冊(cè)證的企業(yè)非常少。牙膠尖通常由古塔膠�、硫酸鋇、氧化鋅�、鈦白粉、碳酸鎂�����、硬脂酸、滑石粉�����、液體石蠟及顏料組成�����,用于根管治療過程中與根管糊劑配合使用進(jìn)行根管充填���、封閉����。2023年10月23日,國(guó)家藥監(jiān)局發(fā)布《牙膠尖注冊(cè)審查指導(dǎo)原則(征求意見稿)》���,詳見正文�����。有意向開展牙膠尖注冊(cè)的醫(yī)療器械注冊(cè)人可關(guān)注本文件���。
牙膠尖注冊(cè)審查指導(dǎo)原則(征求意見稿)
本指導(dǎo)原則旨在指導(dǎo)注冊(cè)申請(qǐng)人對(duì)牙膠尖注冊(cè)申報(bào)資料的準(zhǔn)備及撰寫,同時(shí)也為技術(shù)審評(píng)部門對(duì)注冊(cè)申報(bào)資料的審評(píng)提供技術(shù)參考��。
本指導(dǎo)原則是對(duì)牙膠尖注冊(cè)申報(bào)資料的一般要求�����,注冊(cè)申請(qǐng)人需依據(jù)產(chǎn)品的具體特性確定其中內(nèi)容是否適用��。若不適用��,需具體闡述理由及相應(yīng)的科學(xué)依據(jù)�����,并依據(jù)產(chǎn)品的具體特性對(duì)注冊(cè)申報(bào)資料的內(nèi)容進(jìn)行充實(shí)和細(xì)化。
本指導(dǎo)原則是供注冊(cè)申請(qǐng)人和技術(shù)審評(píng)人員的指導(dǎo)性文件���,但不包括注冊(cè)審批所涉及的行政事項(xiàng)����,亦不作為法規(guī)強(qiáng)制執(zhí)行���,需在遵循相關(guān)法規(guī)和強(qiáng)制性標(biāo)準(zhǔn)的前提下使用本指導(dǎo)原則�����。如果有能夠滿足相關(guān)法規(guī)要求的其他方法����,也可以采用��,但是需要提供詳細(xì)的研究資料和驗(yàn)證資料����。
本指導(dǎo)原則是在現(xiàn)行法規(guī)和標(biāo)準(zhǔn)體系以及當(dāng)前認(rèn)知水平下制定的����,隨著法規(guī)和標(biāo)準(zhǔn)的不斷完善����,以及科學(xué)技術(shù)的不斷發(fā)展��,本指導(dǎo)原則相關(guān)內(nèi)容也將進(jìn)行適時(shí)的調(diào)整�����。
一��、適用范圍
本指導(dǎo)原則適用于根管治療過程中充填或封閉牙髓腔的牙膠尖產(chǎn)品����。牙膠尖一般由古塔膠、氧化鋅���、硫酸鋇等組成���,非通常材質(zhì)的根管充填尖可參考本指導(dǎo)原則適用部分。本指導(dǎo)原則不適用特殊設(shè)計(jì)及創(chuàng)新設(shè)計(jì)的產(chǎn)品��。
二��、注冊(cè)審查要點(diǎn)
注冊(cè)申報(bào)資料宜符合國(guó)家藥品監(jiān)督管理局《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》中的要求,同時(shí)宜符合以下要求:
(一)監(jiān)管信息
1.產(chǎn)品名稱
產(chǎn)品的命名需采用《醫(yī)療器械分類目錄》或國(guó)家標(biāo)準(zhǔn)�����、行業(yè)標(biāo)準(zhǔn)中的通用名稱��,或以產(chǎn)品臨床預(yù)期用途����、固化方式、適用部位為依據(jù)命名���,需符合《醫(yī)療器械通用名稱命名規(guī)則》���、《口腔科器械通用名稱命名指導(dǎo)原則》等相關(guān)法規(guī)的要求。如牙膠尖�����、牙根管充填尖�����、回填牙膠����、熱凝牙膠尖、根管填塞尖等�。
2.分類編碼
根據(jù)《醫(yī)療器械分類目錄》,分類編碼為17-05-03��,管理類別為Ⅲ類����。
3.注冊(cè)單元?jiǎng)澐?/p>
產(chǎn)品注冊(cè)單元的劃分需符合《醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則》的要求。臨床應(yīng)用技術(shù)不同的宜劃分注冊(cè)單元����,如冷牙膠、熱牙膠棒���。
4.結(jié)構(gòu)組成
需明確產(chǎn)品所有組成成分信息�,組成成分需采用通用化學(xué)名稱表述�,如牙膠尖主要由古塔膠/反-1,4- 聚異戊二烯、氧化鋅���、硫酸鋇等組成����。
(二)綜述資料
1.器械及操作原理描述
1.1需明確產(chǎn)品具體組成成分及百分含量,建議列表進(jìn)行說明��。
1.2明確各型號(hào)產(chǎn)品的設(shè)計(jì)依據(jù)及劃分依據(jù)�,提供產(chǎn)品各型號(hào)的結(jié)構(gòu)示意圖,需充分描述產(chǎn)品結(jié)構(gòu)設(shè)計(jì)特征����,包括直徑、長(zhǎng)度����、錐度等尺寸及允差信息。對(duì)于尾端非充填部分采用圓柱設(shè)計(jì)的需進(jìn)行說明����。對(duì)于適應(yīng)特殊根尖結(jié)構(gòu)的牙膠尖,需提交各部分錐度及錐度設(shè)計(jì)依據(jù)�����。
1.3提供產(chǎn)品工作原理/作用機(jī)理��,明確使用時(shí)機(jī)���、使用方法及充填方式�,明確配合設(shè)備及推薦加熱溫度范圍(如適用)��。
2.產(chǎn)品的適用范圍����、適用人群、禁忌證
產(chǎn)品的適用范圍���、適用人群�、禁忌證需與申報(bào)產(chǎn)品的性能��、功能相符�。
2.1適用范圍:牙膠尖一般用于根管治療過程中與根管封閉糊劑配合用于充填或封閉牙髓腔和根管內(nèi)空隙。對(duì)于熱牙膠/牙膠棒��,需明確與充填機(jī)配合使用�。
2.2預(yù)期使用環(huán)境
明確預(yù)期使用的地點(diǎn)(如醫(yī)療機(jī)構(gòu)),說明可能影響其安全性和有效性的環(huán)境條件�。
2.3適用人群
明確目標(biāo)患者人群信息、患者選擇標(biāo)準(zhǔn)信息以及明確使用過程中需要考慮的因素����。明確是否可用于乳牙及根管未發(fā)育完全的年輕恒牙。
2.4禁忌證:通過風(fēng)險(xiǎn)/受益評(píng)估后����,針對(duì)某些疾病�、情況或特定的人群��,認(rèn)為不推薦使用該產(chǎn)品���,應(yīng)當(dāng)明確說明�����,如成分過敏人群�。
3.型號(hào)規(guī)格
需提供產(chǎn)品各型號(hào)規(guī)格的劃分原則�。對(duì)于存在多種型號(hào)、規(guī)格的產(chǎn)品����,需明確各型號(hào)、規(guī)格及裝量的區(qū)別�����。需采用對(duì)比表及帶有說明性文字的圖片��、圖表�����,對(duì)各種型號(hào)、規(guī)格的結(jié)構(gòu)組成及百分含量���、錐度及各段尺寸信息、配合使用的加熱系統(tǒng)�����、裝量信息����、產(chǎn)品特征等方面加以描述。
4.與同類產(chǎn)品或前代產(chǎn)品的比較信息
需提供同類產(chǎn)品(國(guó)內(nèi)外已上市)或前代產(chǎn)品(如有)的信息��,闡述申請(qǐng)注冊(cè)產(chǎn)品的研發(fā)背景和目的��。對(duì)于同類產(chǎn)品����,應(yīng)當(dāng)說明選擇其作為研發(fā)參考的原因。
申請(qǐng)人需綜述同類產(chǎn)品國(guó)內(nèi)外研究及臨床使用現(xiàn)狀及發(fā)展趨勢(shì)�����。列表比較說明申報(bào)產(chǎn)品與參考產(chǎn)品(同類產(chǎn)品或前代產(chǎn)品)在材料工作原理、結(jié)構(gòu)組成�、制造材料、性能指標(biāo)�����、適用范圍��、作用方式�����、應(yīng)用技術(shù)等方面的異同���,性能指標(biāo)的對(duì)比應(yīng)重點(diǎn)關(guān)注產(chǎn)品充填方法及充填效果相關(guān)性能的對(duì)比���。明確產(chǎn)品有無使用新材料、新的活性成分�、新技術(shù)、新設(shè)計(jì)或具有新作用機(jī)理����、新功能。
5.包裝說明
提供產(chǎn)品的包裝信息���,包括包裝形式�����、包裝材料����、包裝工藝�。對(duì)于具有微生物限度要求的醫(yī)療器械,應(yīng)當(dāng)說明保持其微生物限度的包裝信息�����。說明如何確保最終使用者可清晰地辨識(shí)包裝的完整性����。
(三)非臨床資料
1.產(chǎn)品風(fēng)險(xiǎn)管理資料
注冊(cè)申請(qǐng)人需對(duì)產(chǎn)品全生命周期實(shí)施風(fēng)險(xiǎn)管理,提交風(fēng)險(xiǎn)管理資料����,參照GB/T 42062《醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》。注冊(cè)申請(qǐng)人在產(chǎn)品注冊(cè)上市前�,需對(duì)風(fēng)險(xiǎn)管理過程進(jìn)行評(píng)審。評(píng)審需至少確保:風(fēng)險(xiǎn)管理計(jì)劃已被適當(dāng)?shù)貙?shí)施�,綜合剩余風(fēng)險(xiǎn)是可接受的�。評(píng)審結(jié)果需形成風(fēng)險(xiǎn)管理報(bào)告�,需包括生產(chǎn)和生產(chǎn)后信息,具體內(nèi)容參考GB/T 42062第9章和《醫(yī)療器械安全和性能的基本原則》的2.1.2 e)和2.1.2 f)�。
2.醫(yī)療器械安全和性能基本原則清單
說明產(chǎn)品符合《醫(yī)療器械安全和性能基本原則清單》各項(xiàng)適用要求所采用的方法,以及證明其符合性的文件���。
3.產(chǎn)品技術(shù)要求的主要性能指標(biāo)
產(chǎn)品技術(shù)要求需符合相關(guān)國(guó)家標(biāo)準(zhǔn)��、行業(yè)標(biāo)準(zhǔn)和有關(guān)法律��、法規(guī)的相應(yīng)要求���。在此基礎(chǔ)上,注冊(cè)申請(qǐng)人需根據(jù)產(chǎn)品的特點(diǎn)�����,制定保證產(chǎn)品安全��、有效的技術(shù)要求�。產(chǎn)品技術(shù)要求中試驗(yàn)方法需依據(jù)有關(guān)國(guó)家標(biāo)準(zhǔn)、行業(yè)標(biāo)準(zhǔn)��、國(guó)際標(biāo)準(zhǔn)制訂,或經(jīng)過確認(rèn)與驗(yàn)證����。牙膠尖產(chǎn)品可參考YY/T 0495《牙根管充填尖》相關(guān)標(biāo)準(zhǔn)制定相應(yīng)性能要求
3.1產(chǎn)品型號(hào)/規(guī)格及其劃分的說明
列表說明產(chǎn)品的型號(hào)、規(guī)格�,明確產(chǎn)品型號(hào)、規(guī)格的劃分說明��。明示產(chǎn)品的組成成分及百分含量����。提供各型號(hào)產(chǎn)品的結(jié)構(gòu)圖并標(biāo)識(shí)關(guān)鍵尺寸。
3.2性能指標(biāo)
產(chǎn)品技術(shù)要求的主要性能指標(biāo)需包括以下適用內(nèi)容:
3.2.1外觀��。
3.2.2尺寸信息��,包括長(zhǎng)度����、錐度(標(biāo)準(zhǔn)錐度���、大錐度�、各部分錐度)�。
3.2.3物理完整性。
3.2.4顏色標(biāo)識(shí)(如適用)。
3.2.5裝量����。
3.3檢驗(yàn)方法
產(chǎn)品的檢驗(yàn)方法需根據(jù)技術(shù)性能指標(biāo)設(shè)定,檢驗(yàn)方法需優(yōu)先采用公認(rèn)的或已頒布的標(biāo)準(zhǔn)檢驗(yàn)方法(可參考本指導(dǎo)原則參考文獻(xiàn)中引用的相關(guān)標(biāo)準(zhǔn))���。
3.4附錄
產(chǎn)品組成組分及百分含量��、X射線阻射性�、微生物限度��,以資料性附錄形式體現(xiàn)����。
4.同一注冊(cè)單元內(nèi)檢驗(yàn)典型性產(chǎn)品確定原則
同一注冊(cè)單元內(nèi)所檢驗(yàn)的產(chǎn)品應(yīng)當(dāng)能夠代表本注冊(cè)單元內(nèi)其他產(chǎn)品的安全性和有效性,并提供典型性檢驗(yàn)樣品的確定依據(jù)�。對(duì)于錐度不同、錐度存在梯度設(shè)計(jì)的建議分別選取典型性產(chǎn)品���。
5.研究資料
5.1產(chǎn)品性能研究
根據(jù)產(chǎn)品特性及臨床預(yù)期風(fēng)險(xiǎn)����,開展物理和機(jī)械性能驗(yàn)證���,可參考YY/T 0495相關(guān)標(biāo)準(zhǔn)��,選擇適用的項(xiàng)目進(jìn)行研究驗(yàn)證���,包括但不限于如下研究項(xiàng)目:
5.1.1產(chǎn)品外觀及包裝形式�,必要時(shí)可提供圖示說明��。
5.1.2尺寸信息:(1)長(zhǎng)度��,需產(chǎn)品全長(zhǎng)應(yīng)不小于28mm���。對(duì)于其他長(zhǎng)度��,需提交長(zhǎng)度設(shè)定依據(jù)���;(2)錐度,需結(jié)合產(chǎn)品應(yīng)用情景����,明確產(chǎn)品尺寸及錐度設(shè)定依據(jù)��,提交尺寸及錐度驗(yàn)證資料�。
5.1.3物理完整性��,需提交產(chǎn)品無斷裂跡象的研究資料����。
5.1.4 X射線阻射性���,需提交產(chǎn)品X射線阻射性滿足至少6mm厚鋁板的阻射性的驗(yàn)證資料���。
5.1.5顏色標(biāo)識(shí),考慮產(chǎn)品錐度的辨別�,建議采用顏色進(jìn)行標(biāo)識(shí),設(shè)計(jì)顏色需由淺至深以此表明產(chǎn)品錐度的增加��,提交產(chǎn)品錐度與顏色標(biāo)識(shí)對(duì)應(yīng)表���。
5.1.6充填效果及封閉性能���,結(jié)合產(chǎn)品臨床應(yīng)用形式及操作步驟,提交充填效果及封閉性能研究資料�����,可考慮選用離體牙在根管預(yù)備后進(jìn)行充填封閉�。對(duì)于封閉效果可采用觀察根尖3���、6、9mm處橫截面進(jìn)行牙膠密度(牙膠充填面積數(shù))��、染料滲透情況�、葡萄糖微滲漏法等進(jìn)行評(píng)價(jià)。需對(duì)研究結(jié)果進(jìn)行合理性分析提交試驗(yàn)結(jié)果可接受的支持性資料���,可與已上市同類產(chǎn)品應(yīng)用效果對(duì)比說明����。建議參照臨床應(yīng)用形式配合糊劑/封閉劑進(jìn)行充填研究��。對(duì)于擬應(yīng)用于特殊根管的情形����,需一并考慮離體牙根管結(jié)構(gòu)或構(gòu)建相應(yīng)模型進(jìn)行驗(yàn)證。
5.1.7關(guān)于熱牙膠/牙膠棒��,需提交與熱牙膠充填機(jī)的配合使用性能的研究資料��。需對(duì)不同溫度設(shè)定下熱牙膠流動(dòng)性���、固化時(shí)間���、輸送順暢性進(jìn)行評(píng)價(jià),并明確推薦的使用參數(shù)信息及確定依據(jù)��,可結(jié)合充填封閉效果一并分析�。對(duì)于單獨(dú)使用,不與根管糊劑配合使用的產(chǎn)品����,需提交充填封閉效果及根尖周組織情況的研究資料。
5.1.8微生物限度���,需參照《中華人民共和國(guó)藥典》(2020年版)四部1105~1107非無菌產(chǎn)品微生物限度檢查法提交微生物限度驗(yàn)證資料�。
5.2化學(xué)/材料表征研究
提供產(chǎn)品各組成成分及百分含量的確定依據(jù)�,提交各填料組分分散均勻的研究資料。明確產(chǎn)品的起始物質(zhì)��,列明產(chǎn)品生產(chǎn)過程中所需全部材料的化學(xué)名稱�、化學(xué)結(jié)構(gòu)式/分子式、分子量及其分布(如適用)�、來源和純度(如適用)、使用量或組成比例�、符合的標(biāo)準(zhǔn)和申請(qǐng)人的驗(yàn)收標(biāo)準(zhǔn)及相關(guān)的安全性評(píng)價(jià)報(bào)告,建議以列表的形式提供�����。并說明原材料的選擇依據(jù)及來源。
5.3生物學(xué)特性研究
牙膠尖的生物相容性評(píng)價(jià)需遵循GB/T 16886.1《醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過程中的評(píng)價(jià)與試驗(yàn)》和YY/T 0268《牙科學(xué)口腔醫(yī)療器械生物學(xué)評(píng)價(jià)第1單元:評(píng)價(jià)與試驗(yàn)》相關(guān)要求����,生物相容性評(píng)價(jià)資料可以參考《醫(yī)療器械生物學(xué)評(píng)價(jià)指南》,必要時(shí)���,開展生物學(xué)試驗(yàn)����。生物學(xué)評(píng)價(jià)終點(diǎn)一般包括細(xì)胞毒性�、致敏性、急性全身毒性����、刺激或皮內(nèi)反應(yīng)(或口腔粘膜刺激試驗(yàn))、遺傳毒性�����、亞慢性全身毒性�����、根管內(nèi)應(yīng)用。
5.4動(dòng)物試驗(yàn)研究
請(qǐng)根據(jù)《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第一部分:決策原則》要求���,結(jié)合動(dòng)物試驗(yàn)“替代、減少和優(yōu)化”原則及醫(yī)療器械風(fēng)險(xiǎn)管理原則判定開展動(dòng)物試驗(yàn)的必要性�。如需開展動(dòng)物試驗(yàn),請(qǐng)參照《醫(yī)療器械動(dòng)物試驗(yàn)研究技術(shù)審查指導(dǎo)原則第二部分:實(shí)驗(yàn)設(shè)計(jì)�、實(shí)施質(zhì)量保證》進(jìn)行研究方案設(shè)計(jì)和實(shí)施質(zhì)量保證工作。一般對(duì)于工作機(jī)理明確�、設(shè)計(jì)定型,生產(chǎn)工藝成熟�����,且不改變常規(guī)用途的牙膠尖產(chǎn)品不需要進(jìn)行動(dòng)物試驗(yàn)研究����。
5.5穩(wěn)定性研究
5.5.1貨架有效期
注冊(cè)申請(qǐng)人需參照《無菌醫(yī)療器械包裝試驗(yàn)方法第1部分:加速老化試驗(yàn)指南》或《無源植入性醫(yī)療器械貨架有效期注冊(cè)申報(bào)資料指導(dǎo)原則》中適用的部分提供加速穩(wěn)定性試驗(yàn)或?qū)崟r(shí)穩(wěn)定性試驗(yàn)驗(yàn)證資料。牙膠尖中部分成分具有溫度敏感性����,對(duì)于選擇加速穩(wěn)定性研究的需一并提交老化溫度選擇的依據(jù)及合理性支持資料。
5.5.2運(yùn)輸穩(wěn)定性
注冊(cè)申請(qǐng)人需提交運(yùn)輸穩(wěn)定性驗(yàn)證資料���,證明在規(guī)定的運(yùn)輸條件下�,運(yùn)輸過程中環(huán)境條件(例如:震動(dòng)、振動(dòng)�����、溫度和濕度的波動(dòng))不會(huì)對(duì)醫(yī)療器械的特性和性能����,包括完整性和清潔度,造成不利影響��。
5.6免于臨床評(píng)價(jià)支持資料
列入《免于臨床評(píng)價(jià)醫(yī)療器械目錄》(以下簡(jiǎn)稱《目錄》)的產(chǎn)品����,注冊(cè)申請(qǐng)人需提交申報(bào)產(chǎn)品相關(guān)信息與《目錄》所述內(nèi)容的對(duì)比資料以及申報(bào)產(chǎn)品與已獲準(zhǔn)境內(nèi)注冊(cè)的《目錄》中醫(yī)療器械的對(duì)比說明。關(guān)于申報(bào)產(chǎn)品與已獲準(zhǔn)境內(nèi)注冊(cè)的《目錄》中醫(yī)療器械的對(duì)比項(xiàng)目中結(jié)構(gòu)組成的對(duì)比需包括產(chǎn)品組成成分及百分含量的對(duì)比����;物理性能比對(duì) 尺寸、錐度���;產(chǎn)品操作對(duì)比需考慮�����、充填效果��、充填操作性的對(duì)比�。針對(duì)對(duì)比資料中的差異部分,宜提交申報(bào)產(chǎn)品自身的非臨床研究資料證明差異性對(duì)臨床使用的安全性有效性未產(chǎn)生不利影響����,證明申報(bào)產(chǎn)品與《目錄》所述產(chǎn)品具有基本等同性����。
使用了新材料、活性成分���、新技術(shù)���、新設(shè)計(jì)或具有新作用機(jī)理、新功能的產(chǎn)品�,不屬于《目錄》描述范圍的產(chǎn)品,注冊(cè)申請(qǐng)人宜選擇合適的臨床評(píng)價(jià)路徑進(jìn)行評(píng)價(jià)��。
(四)臨床評(píng)價(jià)資料
1.同品種醫(yī)療器械臨床數(shù)據(jù)
對(duì)于不屬于免臨床評(píng)價(jià)目錄內(nèi)的產(chǎn)品����,可按照《醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則》中將同品種醫(yī)療器械的臨床數(shù)據(jù)用于支持申報(bào)產(chǎn)品的安全性、臨床性能和/或有效性的要求。
2.申報(bào)產(chǎn)品臨床試驗(yàn)數(shù)據(jù)
經(jīng)評(píng)價(jià)��,確需開展臨床試驗(yàn)的���,注冊(cè)申請(qǐng)人可參照《決策是否開展醫(yī)療器械臨床試驗(yàn)技術(shù)指導(dǎo)原則》明確需要開展臨床試驗(yàn)的主要考慮因素���,若開展申報(bào)產(chǎn)品臨床試驗(yàn),則需嚴(yán)格按照《醫(yī)療器械臨床試驗(yàn)質(zhì)量管理規(guī)范》進(jìn)行臨床試驗(yàn)��,并提交完整的臨床試驗(yàn)資料��。臨床試驗(yàn)的設(shè)計(jì)可參考《醫(yī)療器械臨床試驗(yàn)設(shè)計(jì)指導(dǎo)原則》�����。
注冊(cè)申請(qǐng)人如有境外臨床試驗(yàn)數(shù)據(jù)����,可參照《接受醫(yī)療器械境外臨床試驗(yàn)數(shù)據(jù)技術(shù)指導(dǎo)原則》的要求提交相關(guān)資料。
(五)產(chǎn)品說明書和標(biāo)簽樣稿
產(chǎn)品說明書和標(biāo)簽需符合《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》和YY/T 0466.1《醫(yī)療器械用于醫(yī)療器械標(biāo)簽�����、標(biāo)記和提供信息的符號(hào)第1部分:通用要求》中的相關(guān)要求���。牙膠尖長(zhǎng)期常溫貯存脆性增加�����,需明確貯存條件��。對(duì)于熱牙膠/牙膠棒��,需明確配合使用的牙膠充填機(jī)及推薦使用參數(shù)信息(溫度使用范圍)����。
(六)質(zhì)量管理體系文件
按照《關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告》提交相關(guān)文件���。
三���、參考文獻(xiàn)
[1] 中華人民共和國(guó)國(guó)務(wù)院.醫(yī)療器械監(jiān)督管理?xiàng)l例:中華人民共和國(guó)國(guó)務(wù)院令第739號(hào)[Z].
[2] 國(guó)家市場(chǎng)監(jiān)督管理總局.醫(yī)療器械注冊(cè)與備案管理辦法:國(guó)家市場(chǎng)監(jiān)督管理總局令第47號(hào)[Z].
[3] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式:關(guān)于公布醫(yī)療器械注冊(cè)申報(bào)資料要求和批準(zhǔn)證明文件格式的公告2021年第121號(hào)[Z]
[4] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械說明書和標(biāo)簽管理規(guī)定:國(guó)家食品藥品監(jiān)督管理總局令第6號(hào)[Z].
[5] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械分類規(guī)則:國(guó)家食品藥品監(jiān)督管理總局令第15號(hào)[Z].
[6] 原國(guó)家食品藥品監(jiān)督管理總局.醫(yī)療器械通用名稱命名規(guī)則:國(guó)家食品藥品監(jiān)督管理總局令第19號(hào)[Z].
[7] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械分類目錄: 總局關(guān)于發(fā)布醫(yī)療器械分類目錄的公告2017年第104號(hào)[Z].
[8] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則: 總局關(guān)于發(fā)布醫(yī)療器械注冊(cè)單元?jiǎng)澐种笇?dǎo)原則的通告2017年第187號(hào)[Z].
[9] 國(guó)家藥監(jiān)局器審中心.無源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則(2022年修訂版):國(guó)家藥監(jiān)局器審中心關(guān)于發(fā)布無源植入性醫(yī)療器械穩(wěn)定性研究指導(dǎo)原則(2022年修訂版)的通告2022年第12號(hào)[Z].
[10] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則第一部分:決策原則(2021年修訂版): 國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第一部分:決策原則(2021年修訂版)等2項(xiàng)注冊(cè)審查指導(dǎo)原則的通告2021年第75號(hào)[Z].
[11] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第二部分:試驗(yàn)設(shè)計(jì)、實(shí)施質(zhì)量保證: 國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則 第一部分:決策原則(2021年修訂版)等2項(xiàng)注冊(cè)審查指導(dǎo)原則的通告2021年第75號(hào)[Z].
[12] 國(guó)家藥品監(jiān)督管理局.醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則:國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械臨床評(píng)價(jià)技術(shù)指導(dǎo)原則等5項(xiàng)技術(shù)指導(dǎo)原則的通告2021年第73號(hào) [Z].
[13] 國(guó)家藥品監(jiān)督管理局.口腔科器械通用名稱命名指導(dǎo)原則:國(guó)家藥監(jiān)局關(guān)于發(fā)布醫(yī)用成像器械通用名稱命名指導(dǎo)原則等3項(xiàng)指導(dǎo)原則的通告2020年第41號(hào)[Z].
[14] YY/T 0495,牙根管充填尖 [S].
[15] GB/T 16886.1,醫(yī)療器械生物學(xué)評(píng)價(jià)第1部分:風(fēng)險(xiǎn)管理過程中的評(píng)價(jià)與試驗(yàn) [S].
[16] GB/T 16886.3,醫(yī)療器械生物學(xué)評(píng)價(jià) 第3部分:遺傳毒性���、致癌性和生殖毒性試驗(yàn) [S].
[17] GB/T 16886.5,醫(yī)療器械生物學(xué)評(píng)價(jià) 第5部分:體外細(xì)胞毒性試驗(yàn)[S].
[18] GB/T 16886.10,醫(yī)療器械生物學(xué)評(píng)價(jià) 第10部分:刺激與皮膚致敏試驗(yàn)[S].
[19] GB/T 16886.11,醫(yī)療器械生物學(xué)評(píng)價(jià) 第11部分:全身毒性試驗(yàn)[S].
[20] YY/T 0268,牙科學(xué) 口腔醫(yī)療器械生物學(xué)評(píng)價(jià) 第1單元:評(píng)價(jià)與試驗(yàn)[S].
[21] GB/T 42062,醫(yī)療器械 風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用[S].
[22] YY/T 0466.1,醫(yī)療器械 用于醫(yī)療器械標(biāo)簽��、標(biāo)記和提供信息的符號(hào)第1部分:通用要求[S].
[23] 林紅. 口腔材料學(xué). 第2版. 北京: 北京大學(xué)醫(yī)學(xué)出版社, 2013.178-204. [M].
[24] 趙信義. 口腔材料學(xué).第6版. 北京: 人民衛(wèi)生出版社, 2020. 99-104. [M].
標(biāo)簽:第三類醫(yī)療器械注冊(cè)流程