對于在醫(yī)療器械注冊進程中�����,臨床試驗前��,醫(yī)療器械產(chǎn)品是否需要做動物實驗對很多行業(yè)從業(yè)者都是一個問題�����,今年初�,國家藥品監(jiān)督管理局組織制定了《醫(yī)療器械動物實驗研究技術審查指導原則 第一部分:決策原則》�����,為企業(yè)提供了是否需要做動物實驗決策的法規(guī)依據(jù)。
引言:對于在醫(yī)療器械注冊進程中����,臨床試驗前,醫(yī)療器械產(chǎn)品是否需要做動物實驗對很多行業(yè)從業(yè)者都是一個問題�,今年初,國家藥品監(jiān)督管理局組織制定了《醫(yī)療器械動物實驗研究技術審查指導原則 第一部分:決策原則》��,為企業(yè)提供了是否需要做動物實驗決策的法規(guī)依據(jù)����。
一、醫(yī)療器械注冊是否需要做動物實驗的法規(guī)依據(jù):
2019年4月18日�,國家藥監(jiān)局為加強醫(yī)療器械產(chǎn)品注冊工作的監(jiān)督和指導,進一步提高注冊審查質量�,國家藥品監(jiān)督管理局組織制定了《醫(yī)療器械動物實驗研究技術審查指導原則 第一部分:決策原則》,為企業(yè)和審評人員�、監(jiān)管人員判定醫(yī)療器械注冊過程中是否需要做動物實驗提供了法規(guī)依據(jù)。
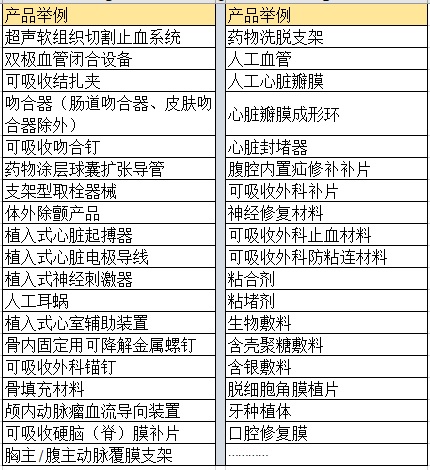
二���、醫(yī)療器械注冊過程中可能需要做動物實驗的產(chǎn)品舉例:
杭州證標客醫(yī)藥技術咨詢有限公司位于中國杭州����,是醫(yī)療器械專業(yè)服務第三方。為廣大客戶提供醫(yī)療器械法律法規(guī)���、經(jīng)營開辦��、醫(yī)療器械生產(chǎn)質量管理體系、醫(yī)療器械注冊��、臨床��、CRC�、CE、FDA�����、醫(yī)療信息系統(tǒng)定制開發(fā)一站式服務����,是江浙滬地區(qū)極少數(shù)有醫(yī)療器械全流程服務能力的機構之一。任何有關醫(yī)療器械注冊�、醫(yī)療器械經(jīng)營許可/備案、醫(yī)療器械臨床試驗�、CRC服務事宜,隨時方便聯(lián)系葉工(MP:18058734169����,微信同)�����。